
cis-trans-isomerismo ou isomeria geométrica- um dos tipos de estereoisomerismo: consiste na possibilidade de os substituintes estarem localizados em um ou em lados opostos do plano da ligação dupla ou anel não aromático. Todos os isômeros geométricos são diastereômeros, pois não são imagens especulares uns dos outros. cis- e transe-isômeros são encontrados tanto entre compostos orgânicos quanto entre inorgânicos. Conceitos cis e transe não são usadas no caso de conformadores, duas geometrias que fluem facilmente uma para a outra, as designações "syn" e "anti" são usadas em seu lugar.
Designações « cis" e " transe» veio do latim, traduzido desta língua cis significa "de um lado" e transe- “do outro lado” ou “oposto”. O termo "isomerismo geométrico" de acordo com a IUPAC é considerado um sinônimo obsoleto cis-transe-isomerismo.
Deve-se lembrar que cis-trans- a nomenclatura descreve relativo arranjo de substituintes, e não deve ser confundido com E, Z- uma nomenclatura que dá absoluto descrição estereoquímica e só se aplica a alcenos.
cis-trans Os compostos alicíclicos também exibem isomerismo, no qual os substituintes podem estar localizados em um ou em lados opostos do plano do anel. Um exemplo é 1,2-diclorociclohexano:
 |
  |
| transe-1,2-diclorociclohexano | cis-1,2-diclorociclohexano |
 |
 |
| cis-2-penteno | transe-2-penteno |
 |
 |
| cis-1,2-dicloroetileno | transe-1,2-dicloroetileno |
 |
 |
| cis-ácido butenodioico (ácido maleico) |
transe-ácido butenodioico (ácido fumárico) |
 |
 |
| Ácido oleico | ácido elaídico |
As diferenças podem ser sutis, como é o caso do ponto de ebulição de alcenos de cadeia linear, como o 2-penteno. cis-isômero que ferve a 37°C, e transe-isômero - a 36°C. Diferença entre cis- e transe- torna-se ainda maior se houver ligações polarizadas na molécula, como no 1,2-dicloroetileno. cis-isômero neste caso ferve a 60,3 ° C, mas transe-isômero ferve a 47,5°C. Quando cis O efeito isômero de duas ligações polares C-Cl se somam para formar um dipolo molecular forte, que dá origem a fortes interações intermoleculares (forças de Keessom), que se somam às forças de dispersão e levam a um aumento no ponto de ebulição. NO transe-isômero, pelo contrário, isso não acontece, uma vez que os dois momentos das ligações C-Cl estão localizados em frente um ao outro e se cancelam sem criar um momento dipolar adicional (embora seu momento quadrupolar não seja zero).
Os dois isômeros geométricos do ácido butenodioico são tão diferentes em suas propriedades e reatividade que até receberam nomes diferentes: cis-isômero é chamado de ácido maleico, e transe-isômero - ácido fumárico. A propriedade chave que determina o ponto de ebulição relativo é a polaridade da molécula, uma vez que aumenta as interações intermoleculares, elevando assim o ponto de ebulição. Da mesma forma, a simetria determina o ponto de fusão, uma vez que moléculas simétricas empacotam melhor no estado sólido, mesmo que a polaridade da molécula não mude. Um exemplo de tal dependência são os ácidos oleico e elaídico; Ácido oleico, cis-isômero, tem um ponto de fusão de 13,4 ° C e torna-se um líquido à temperatura ambiente, enquanto transe-isômero, ácido elaídico, tem um ponto de fusão mais alto de 43 ° C porque é mais direto transe-isômero tem um empacotamento mais denso e permanece sólido à temperatura ambiente.
cis-trans-isômeros de ácidos dicarboxílicos também diferem em acidez: ácido maleico ( cis) é um ácido significativamente mais forte que fumárico ( transe). Então, a primeira constante de dissociação para o ácido fumárico pK a1= 3,03, e para ácido maleico pK a1= 1,9. Pelo contrário, a constante de dissociação do segundo grupo carboxila para o ácido fumárico é maior do que para o ácido maleico, a saber: para o ácido fumárico pKa2= 4,44, e para ácido maleico pKa2= 6,07. Devido à proximidade espacial dos grupos carboxila em cis- forma, a tendência do hidrogênio para ionizar aumenta, então a primeira constante do ácido maleico é maior. No entanto, é mais difícil para o segundo próton superar a atração de dois grupos carboxila próximos em cis-isômero, então a segunda constante de dissociação do ácido maleico é menor que a do ácido fumárico. Um princípio semelhante se aplica aos ácidos dicarboxílicos alicíclicos, no entanto, à medida que o tamanho do anel aumenta, a influência da forma do anel não planar também deve ser levada em consideração.
A constante de acoplamento spin-spin nuclear vicinal (3 J HH) medido por espectroscopia de RMN, mais para transe-isômeros (intervalo: 12-18 Hz; média: 15 Hz) do que para cis-isômeros (intervalo: 0-12 Hz; média: 8 Hz).
Como regra para sistemas acíclicos transe cis. A razão para isso é geralmente aumentar as interações estéricas indesejadas de substituintes próximos cis-isômero. Pela mesma razão, o calor específico de combustão transe-isômeros menores que cis, o que indica maior estabilidade termodinâmica. As exceções a esta regra são 1,2-difluoroetileno, 1,2-difluorodiazeno (FN=NF), 1-bromopropeno-1 e vários outros etilenos substituídos por halogênio e oxigênio. Nesse caso cis-isômero é mais estável do que transe-isômero, uma vez que entre tais substituintes não prevalecem forças repulsivas, mas forças atrativas (como as forças de London). Além disso, devido ao volume relativamente pequeno de substituintes, não surge impedimento estérico. Dos 1,2-dihaloetilenos, apenas o 1,2-diiodoetileno possui um isômero trans mais estável do que cis-isômero, porque devido ao grande raio, os átomos de iodo experimentam forte interação espacial se estiverem do mesmo lado da ligação dupla.
Os isômeros geométricos, cuja diferença está relacionada à posição dos substituintes ao redor da ligação dupla, diferem das formas estereoisoméricas de um tipo diferente - confórmeros. existência separada cis- e transe-isômeros, em essência, só é possível devido à alta barreira de energia de rotação em torno da ligação dupla, o que torna possível separar a existência cis- e transe-isômeros, enquanto os confórmeros existem apenas na forma de uma mistura em equilíbrio. O valor da barreira de rotação em torno da ligação dupla em alcenos simples é 250-270 kJ/mol. No entanto, se doadores de elétrons fortes (-SR) forem colocados de um lado, e grupos, aceptores de elétrons fortes (-CN, -COC 6 H 5) forem colocados do outro, polarizando assim a ligação dupla, isso levará a uma significativa diminuição da barreira de rotação. A barreira à rotação em torno de uma ligação assim polarizada pode ser reduzida para 60-100 kJ/mol. Barreiras de baixa energia quando a diferença de energia entre cis-trans-isômeros e confórmeros são suavizados, encontrados para derivados de amina de éster acetoacético e enaminocetonas. Mostra-se que a posição de equilíbrio em tais sistemas depende da natureza do solvente. Assim, as enaminocetonas em solventes apolares estão 100% presentes em cis-forma estabilizada por uma ligação de hidrogênio interna, e em solventes polares até 50% transe-formulários.
sistema de notação cis-transeé bem aplicável apenas para nomear alcenos isoméricos com dois tipos diferentes de substituintes na ligação dupla, em moléculas complexas essa nomenclatura se torna muito vaga. Nesses casos, a IUPAC desenvolvida E,Z- uma notação que define exclusivamente o nome dos compostos para todos os casos possíveis e, portanto, é especialmente útil para nomear alcenos tri- e tetra-substituídos. Este sistema evita confusão sobre quais grupos devem ser considerados. cis- ou transe- em relação ao outro.
Se os dois grupos mais antigos estiverem localizados do mesmo lado da ligação dupla, ou seja, eles estão em cis- posição entre si, então essa substância é chamada Z-isômero (do alemão zusammen - juntos). Quando os grupos mais antigos estão localizados em lados opostos da ligação dupla (em transe-orientação), então tal isômero é chamado E-isômero (do alemão entgegen - oposto). A ordem de precedência de grupos e átomos é determinada pelas regras de Kahn - Ingold - Prelog. Para cada um dos dois átomos na ligação dupla, é necessário determinar a antiguidade de cada substituinte. Se ambos os substituintes seniores estiverem localizados no mesmo lado do plano da ligação π, essa configuração será denotada pelo símbolo Z, se esses grupos estão em lados opostos do plano de ligação π, então a configuração é denotada pelo símbolo E .
Deve-se notar que cis/transe e E,Z-nomenclaturas são baseadas na comparação de diferentes substituintes de alcenos, portanto Z-isômero nem sempre corresponde cis-isômero, e E-isômero - transe-isômero. Por exemplo, transe-2-clorobuteno-2 (dois grupos metil C1 e C4, na cadeia principal de buteno-2a estão em transe-orientação) é ( Z)-2-clorobuteno-2 (o cloro é mais antigo que o metil, que por sua vez é mais antigo que o hidrogênio, então o cloro e o C4-metil são considerados juntos).
cis–transe-isomerismo também é encontrado em compostos inorgânicos, principalmente em diazenos e compostos complexos.
Diazenes (e difosfenos relacionados) exibem cis-trans- isomeria. Assim como os compostos orgânicos, cis-isômero é mais reativo, apenas é capaz de reduzir alcenos e alcinos a alcanos. Transe-isômero, aproximando-se do alceno, não consegue alinhar seus átomos de hidrogênio para reduzir efetivamente o alceno, e cis-isômero devido à forma apropriada lida com sucesso com essa tarefa.
  |
  |
| transe- diazeno | cis- diazeno |
Compostos de coordenação inorgânicos com geometria quadrada octaédrica ou plana também são subdivididos em cis-isômeros nos quais os mesmos ligantes estão localizados lado a lado, e transe-isômeros nos quais os ligantes são separados uns dos outros.
Por exemplo, existem dois isômeros geométricos planos quadrados para Pt(NH 3) 2 Cl 2 , um fenômeno que Alfred Werner explicou em 1893. cis-isômero com nome completo cis-diclorodiaminaplatina(II) tem atividade antitumoral, que foi demonstrada por Barnett Rosenberg em 1969. Agora esta substância é conhecida na quimioterapia sob o nome curto cisplatina. Transe-isômero (transplatina), pelo contrário, não possui atividade medicinal. Cada um desses isômeros pode ser sintetizado com base no efeito trans, o que possibilita obter predominantemente o isômero desejado.
 |
 |
|
cis- + e transe- + |
||
Para complexos octaédricos com a fórmula MX 4 Y 2, existem também dois isômeros. (Aqui M é um átomo de metal e X e Y são tipos diferentes de ligantes.) cis-isômero, dois ligantes Y são adjacentes um ao outro em um ângulo de 90°, como mostrado para átomos de cloro em cis- + na imagem à esquerda. NO transe-isômero mostrado à direita, dois átomos de cloro estão localizados em extremidades opostas da diagonal que passa pelo átomo central de cobalto.
Um tipo semelhante de isomerismo de complexos octaédricos MX 3 Y 3 é grand os-isomerismo, ou isomerismo face-axial, quando um certo número de ligantes estão em cis- ou transe- posição entre si. NO avó-isômeros, ligantes do mesmo tipo ocupam os vértices da face triangular do octaedro, e em SO-isômeros, os mesmos ligantes estão em três posições adjacentes, de modo que dois ligantes estão em lados opostos do átomo central e no mesmo eixo com ele
Os isômeros geométricos surgem quando a rotação livre dos átomos em uma molécula é limitada devido à presença de uma ligação dupla. Os ácidos maleico (12.23) e fumárico (12.24) (cis- e trans-respectivamente) podem servir como um exemplo de tal par de isômeros.
Os isômeros geométricos são muito semelhantes em estrutura química, mas não são imagens espelhadas um do outro e não giram o plano de polarização da luz. Como regra, os isômeros cis e trans diferem significativamente nas propriedades físicas. Por exemplo, o ácido maleico (12,23) funde a 130°C, seu valor de pKa é 1,9, é muito solúvel em água fria (79 g por 100 ml); as constantes de seu isômero geométrico - ácido fumárico (12,24) são, respectivamente, 287 ° C, 3,0 e 0,7 g por 100 ml. Não é de surpreender que os isômeros geométricos tenham propriedades biológicas diferentes e, portanto, é muito importante ao estudar a fórmula química de um novo composto levar em conta todas as possibilidades de existência desse tipo de isomerismo.
Os isômeros cis e trans podem ser facilmente separados por cristalização ou cromatografia. Não existe um método geral para converter um isômero em outro, mas o aquecimento geralmente produz o isômero mais estável e a exposição à luz produz o isômero menos estável. A visão humana depende da conversão do isômero 11-cis da retina para a forma 11-trans sob a ação da luz. Assim que o excitante feixe de luz desaparece,
este pigmento carotenóide volta para a forma cis, interrompendo assim o impulso que vai para o cérebro.
Os isômeros cis e trans também existem no anel plano do ciclopentano, que é como uma grande ligação dupla. Embora o anel ciclo-hexano não seja plano, ele é suficientemente plano para formar isômeros cis e trans. Assim, as formas cis-(12.25) e trans-(12.26) de diaminociclohexano existem e estão disponíveis. A mesma molécula pode formar isômeros geométricos e ópticos. Por exemplo, o isômero trans (12.26) pode ser separado nos isômeros quirais (S,S) (12.27) e (R,R) (12.28). No entanto, o isômero cis não pode ser dividido em formas quirais, pois possui um plano de simetria. O anel benzênico não possui isômeros geométricos, pois cada átomo de carbono do anel possui apenas um substituinte.
Estereoisômeros de 1,2-diaminocinlogensano
Às vezes é difícil selecionar dois dos quatro substituintes em uma ligação dupla para determinar a configuração cis ou trans. A regra da sequência prescreve a escolha dos substituintes com os átomos mais pesados, enquanto a forma cis é denotada pela letra Z (da palavra alemã zusammen), e a transformada pela letra E (entgegen). Às vezes, nos nomes de compostos em que o isomerismo geométrico pode se manifestar repetidamente, o substituinte com o menor número (de acordo com a regra de numeração) é indicado pela letra r, e as designações c-(cis) e t-(trans) em frente de outros substituintes mostram sua posição em relação ao Sr. Deputado.
Semelhante ao ácido indol-3-ilacético (4.82), que estimula o crescimento das células vegetais, outros ácidos carboxílicos também podem atuar, cujo grupo carboxila está em ângulo com o plano do anel aromático. O isomerismo geométrico limita a possibilidade de tal arranjo de dois substituintes, portanto, dos ácidos cinâmicos, apenas o cisisômero é ativo. Nos ácidos 2-fenilciclopropano-1-carboxílico e 1,2,3,4-tetra-hidronaftalideno-1-acético, apenas os isômeros cis também são ativos. Modelos moleculares mostram que o anel e o grupo carboxila no isômero trans (inativo) dessas substâncias estão no mesmo plano, enquanto na forma cis (ativo) eles não são coplanares. Ele foi o primeiro a apontar essa conexão entre
não coplanaridade e atividade estimulante do crescimento de Veidstra. A não-coplanaridade também pode surgir devido a impedimentos estéricos. Assim, o ácido benzóico tem uma forma plana e não é ativo, enquanto os ácidos 2,6-diclorobenzóico e 8-metil-1-naftóico são não-planares e biologicamente ativos.
Em análogos de auxinas, o grupo carboxila também pode ser substituído por outros grupos retiradores de elétrons (-CN, -NO 2 , -SO3H), enquanto a atividade biológica diminui apenas ligeiramente. Para a conexão entre estrutura e ação nesta série, ver Koepfli, Thimann, Went (1938) e Veidstra (1963).
A isomeria geométrica dos esteróides merece consideração especial. A fórmula (12.29) mostra a estrutura geral deste grupo de compostos naturais saturados (a numeração dos átomos de carbono e as designações das letras dos quatro ciclos são mostradas). Nos esteróides naturais, os anéis B e C estão em uma junção trans, ambos ancorados em uma conformação em cadeira. Nos glicosídeos cardíacos, a junção dos ciclos C e D tem uma configuração cis, mas nos hormônios animais, esteróis e ácidos biliares, tem uma junção trans. Na maioria dos esteróides biologicamente ativos, os anéis A e B estão em uma junção trans (fila "5a", anteriormente chamada "allo"). Cada um dos anéis na molécula de esteróide forma dobras, o que é claramente visto na projeção lateral da fórmula (12.30).

A designação "5a" indica que o átomo de hidrogênio na posição 5 está abaixo do plano comum dos anéis. Todos os substituintes localizados abaixo deste plano são designados pelo símbolo "a", e acima - pelo símbolo "p". os substituintes a são indicados por linhas pontilhadas e os substituintes ^ por linhas sólidas. Os símbolos a- e ^- também são usados para outros compostos policíclicos, por exemplo, triterpenos e alcalóides. A complexidade da estrutura desses compostos dificulta o uso da nomenclatura R e S.
Como regra, em mamíferos, a alta atividade biológica dos compostos esteróides está associada à ausência de substituintes a nas posições 1, 9, 11-13, 17 e à ausência de substituintes p nas posições 4-8, 14, 15 A projeção lateral da molécula de hidrocortisona ilustra essa regra. O primeiro passo na ação biológica dos hormônios esteróides é seu efeito no transporte específico de proteínas (seção 2.4). Supõe-se que os esteróides interagem com as proteínas pelo lado inferior plano (a-superfície) da molécula.
Os vários esteróides diferem uns dos outros principalmente nos substituintes R1, R2 e R3 (12,29), mas às vezes também no grau de insaturação ou na presença de outros substituintes fora dos anéis. Para que um esteróide tenha atividade progestina, androgênica e corticóide, via de regra, é necessária a presença de uma estrutura ciclohexenona do anel A. Átomos de oxigênio nas posições 3, 11 e 17 e o grupo característico -CO-CH 2 OH na posição 17. A atividade androgênica e corticóide depende em maior medida desses detalhes estruturais da molécula, no entanto, a atividade da progestina é preservada se o grupo acetil na posição 17 estiver na configuração a, que não é encontrada em compostos naturais, e a substituição do grupo metil na posição 18 por etil leva até a aumentar essa atividade (contraceptivo oral norgestrel).
De todos os hormônios esteróides, os compostos com atividade estrogênica impõem os requisitos menos rigorosos na estrutura. Sob a condição de aromatização do anel A e a presença de um grupo hidroxila ácido na posição 3, a estrutura do restante da molécula é de importância secundária. Em 1938, apareceram análogos de benzeno simples e altamente eficazes de estrogênios esteróides. Embora se acreditasse que suas moléculas eram semelhantes em forma às dos esteróides, na realidade não há muito em comum entre eles. De acordo com a análise de difração de raios X, a molécula de dietilestilbestrol (12.31) tem uma configuração trans, distorcida devido ao impedimento estérico criado pelos fragmentos metileno de dois grupos etil. Portanto, dois anéis de benzeno formam um ângulo diedro de 63° com o fragmento de etileno, o que torna a forma da molécula completamente diferente da de um esteróide. No entanto, nestas moléculas, a distância entre os átomos de oxigênio é aproximadamente a mesma: 1,21 nm no dietilestilbestrol e de 1,07 a 1,11 nm nos estrogênios esteróides, mas todas essas moléculas são muito rígidas e, portanto, não conseguem interagir com o mesmo receptor, em que a distância entre os pontos de conexão é fixa. Sabe-se que para a manifestação da atividade estrogênica é necessária a formação de duas ligações de hidrogênio do receptor com os átomos de oxigênio do ligante, portanto, o receptor deve ter certa flexibilidade. Oki, Urushibara (1952) observou pela primeira vez que o efeito do dietilestilbestrol também está associado à espessura de sua molécula, que é de 0,45 nm e é igual à espessura das moléculas de estrogênios esteróides.

Dietilestilbestrol 3,4-di (4-hidroxifenil) hex-3-eno
(12.31), um substituto eficaz e barato para o principal hormônio feminino estradiol (12.32), surgiu em 1938. Essa droga sintética, que difere do hormônio natural pela alta eficiência quando administrada por via oral e maior duração de ação, tornou-se a principal droga na terapia endócrina. Alguma desconfiança em relação a esse medicamento surgiu com base em dois fatores: primeiro, tem sido amplamente utilizado para aumentar o peso dos animais de fazenda e, segundo, houve casos de câncer em mulheres cujas mães o tomaram durante a gravidez. Apesar disso, o dietilestilbestrol continua sendo amplamente utilizado e considerado seguro; não é prescrito apenas nos primeiros três meses de gravidez (que, aliás, se aplica igualmente ao hormônio natural). Para o uso de seu fosfato para o tratamento do câncer de próstata, ver Sec. 4.2. Propriedades estrogênicas semelhantes são exibidas pelo derivado diidro dietil-estilbestrol-sinestrol (12.33, a) (configuração 3R, 4S). Ele se liga à proteína de ligação ao estrogênio (seção 2.4) mais fortemente do que o próprio dietilestilbestrol, e seu homólogo inferior, o norhexestrol (12.33, b), interage ainda mais fortemente com essa proteína.
Os glicosídeos cardíacos são discutidos na Sec. 14.1. Para uma apresentação detalhada da química e estereoquímica dos esteróides, veja Shoppee (1964), bioquímica e farmacologia - Briggs, Christie (1977).
O isomerismo geométrico do ácido 4-aminocrotônico, que ajudou a determinar a conformação ativa do neurotransmissor ácido gama-aminobutírico, é discutido na Sec. 12.7.
A configuração inclui isomeria óptica e geométrica.
ISOMERIA ÓPTICA
Em 1815, J. Biot descobriu a existência de atividade óptica para compostos orgânicos. Verificou-se que alguns compostos orgânicos têm a capacidade de girar o plano de polarização da luz polarizada. As substâncias que possuem essa capacidade são chamadas de opticamente ativas.
Se um feixe de luz comum, no qual, como é sabido, as oscilações eletromagnéticas se propagam em diferentes planos perpendiculares à direção de sua propagação, passa por um prisma de Nicol, então a luz que sai será polarizada no plano. oscilações eletromagnéticas ocorrem apenas em um plano. Este plano é chamado de plano de polarização (Fig. 3.2).
Quando um feixe de luz polarizada passa através de uma substância opticamente ativa, o plano de polarização gira em um certo ângulo α para a direita ou para a esquerda. Se a substância desvia o plano de polarização para a direita (quando observada em direção ao feixe), é chamada de destra, se para a esquerda - canhota. A rotação direita é indicada pelo sinal (+), a esquerda - pelo sinal (-).
Arroz. 3.2. Esquema de formação de luz polarizada e rotação do plano de polarização por uma substância opticamente ativa
A atividade óptica é medida usando instrumentos chamados polarímetros.
O fenômeno da atividade óptica é comum entre as substâncias orgânicas, principalmente entre as naturais (hidroxi- e aminoácidos, proteínas, carboidratos, alcalóides).
A atividade óptica da maioria dos compostos orgânicos é devido à sua estrutura.
Uma das razões para o aparecimento da atividade óptica das moléculas orgânicas é a presença em sua estrutura de átomos de carbono hibridizados sp 3 associados a quatro substituintes diferentes. Tal átomo de carbono é chamado quiral ou assimétrico. Muitas vezes, um nome mais geral é usado para isso - um centro quiral. Nas fórmulas estruturais, um átomo de carbono assimétrico é geralmente indicado por um asterisco - C *:

Compostos contendo um átomo de carbono assimétrico existem como dois isômeros, relacionados entre si como um objeto à sua imagem especular. Esses isômeros são chamados enantiômeros.

Arroz. 3.3. Modelos de Moléculas Enantioméricas de Bromioclorometano
Fórmulas estereoquímicas podem ser usadas para descrever a estrutura espacial de isômeros ópticos em um plano. Por exemplo, os enantiômeros de butanol-2, representados usando fórmulas estereoquímicas, são os seguintes:

No entanto, as fórmulas estereoquímicas nem sempre são convenientes para descrever a estrutura espacial das moléculas. Portanto, os isômeros ópticos são mais frequentemente representados em um plano usando as fórmulas de projeção de Fisher. Por exemplo, é assim que se parecem os enantiômeros do 2-bromobutano, representados pela projeção de Fischer.

Os enantiômeros são muito semelhantes entre si, mas não são idênticos. Eles têm a mesma composição e sequência de átomos de ligação em uma molécula, mas diferem uns dos outros em sua localização relativa no espaço, ou seja, configuração. É fácil verificar que essas moléculas são diferentes ao tentar sobrepor seus modelos umas às outras.
A propriedade das moléculas de não estarem alinhadas com sua imagem especular é chamada de quiralidade (do grego, cheir - mão), e as moléculas também são chamadas de quirais. Um bom exemplo são as mãos esquerda e direita, que são imagens espelhadas uma da outra, mas ao mesmo tempo não podem ser combinadas. Moléculas que são compatíveis com sua imagem especular são chamadas aquirais.
A quiralidade das moléculas é um pré-requisito para a manifestação da atividade óptica por uma substância.
Como determinar se uma molécula é quiral? A quiralidade de uma molécula pode ser facilmente detectada construindo um modelo da molécula e um modelo de sua imagem especular, seguidos de sua superposição. Se os modelos não corresponderem, a molécula é quiral; se corresponderem, é aquiral. A mesma conclusão pode ser feita com base nas fórmulas estereoquímicas das moléculas pela presença ou ausência de elementos de simetria, pois a razão da atividade óptica dos compostos orgânicos é sua estrutura assimétrica. Como a molécula é uma formação tridimensional, sua estrutura pode ser considerada do ponto de vista da simetria das formas geométricas. Os principais elementos de simetria são o plano, o centro e o eixo de simetria. Se não houver plano de simetria na molécula, então tal molécula é quiral.
Os enantiômeros têm as mesmas propriedades físicas e químicas (ponto de ebulição, ponto de fusão, solubilidade, condutividade elétrica e outras constantes serão as mesmas), giram o plano de polarização do feixe polarizado no mesmo ângulo, mas existem diferenças.
Os enantiômeros diferem no sinal de rotação, um gira o plano de polarização do feixe polarizado para a esquerda, o outro para a direita; eles reagem em taxas diferentes com outros compostos quirais, e também há uma diferença na ação fisiológica. Por exemplo, a droga levomicina é um antibiótico de amplo espectro. Se sua eficiência for tomada como 100, então a forma dextrorotatória será apenas 2% da eficiência da forma levógira.
Se a molécula tem um átomo assimétrico, então existe na forma de dois isômeros, mas se a molécula tem vários átomos de carbono assimétricos, então o número de isômeros possíveis aumenta. O número de isômeros ópticos é determinado pela fórmula:
onde N é o número de isômeros; n é o número de átomos de carbono assimétricos.
Portanto, se houver dois átomos de carbono assimétricos na molécula, o número de isômeros é 2 2 \u003d 4, três - 2 3 \u003d 8, quatro - 2 4 \u003d 16, etc.
Por exemplo, o ácido bromomálico, que contém dois átomos de carbono assimétricos, existe como quatro estereoisômeros (I-IV).

Os estereômeros I e II, assim como III e IV, se relacionam como um objeto e sua imagem especular e são enantiômeros.
Os estereoisômeros 1 e III, 1 e IV, assim como II e HI, H e IV não são imagens especulares um do outro, eles diferem na configuração em um dos átomos de carbono assimétricos. Esses estereoisômeros são chamados diastereômeros. Ao contrário dos enantiômeros, os diastereômeros têm propriedades físicas e químicas diferentes.
Para compostos contendo dois átomos de carbono quirais ligados aos mesmos substituintes, o número total de estereoisômeros é reduzido para três. Por exemplo, o ácido tartárico deve existir como quatro estereoisômeros (2 2 = 4), mas apenas três são conhecidos. Isso se deve ao aparecimento em um dos estereoisômeros de um elemento como um plano de simetria.

Os estereómeros 1 e II são enantiómeros. Estereoisômero III (forma meso) é opticamente inativo. A molécula de ácido mesotartárico é aquiral. Cada enantiômero do ácido tartárico, em relação à forma meso, é um diastereômero.
Nomenclatura de isômeros ópticos
Na nomenclatura, juntamente com o nome do composto, também são indicados a configuração e o sentido de rotação do plano da luz polarizada. Este último é indicado por um sinal (+) para um isômero dextrorotatório ou um sinal (-) para um isômero levógiro.
Para designar a configuração dos isômeros ópticos, existem D, L- e R,S sistemas estereoquímicos.
D,L-sistema de designação de configuração. Determinar a configuração absoluta das moléculas provou ser uma tarefa desafiadora para os químicos. Pela primeira vez, isso só foi possível em 1951 pelo método de análise de difração de raios-X. Até então, a configuração dos isômeros ópticos era estabelecida por comparação com uma substância padrão especialmente selecionada. Essa configuração é chamada relativa. Em 1906, o cientista russo M.A. Rozanov propôs o gliceraldeído como padrão para estabelecer a configuração relativa,

Para o isômero dextrógiro foi escolhida a fórmula de Fischer, na qual o grupo hidroxila no átomo de carbono quiral está à direita e para o isômero canhoto está à esquerda. A configuração do isômero dextrorotatório é indicada pela letra D e o isômero canhoto por L.
Usando o gliceraldeído como padrão de referência, foi desenvolvido um sistema D,L para a classificação estereoquímica de compostos quirais, ou seja, atribuindo compostos às séries estereoquímicas D ou L, respectivamente
O sistema D,L é usado principalmente na série de álcoois poli-hídricos, hidroxi-, aminoácidos e carboidratos:

Para compostos com vários átomos de carbono assimétricos, como α-piroxiácidos, α-aminoácidos, ácidos tartáricos, a configuração é condicionalmente determinada pelo átomo de carbono assimétrico superior (pela chave de hidroxiácido), enquanto na molécula de carboidrato a configuração é (condicionalmente) determinado pelo átomo de carbono assimétrico inferior.

R,S-sistema de designação de configuração. D, L- o sistema acabou sendo praticamente inaceitável para compostos que têm pouca semelhança com o gliceraldeído. Portanto, R Kahn, K. Ingold e V. Prelog propuseram R,S- um sistema para designar a configuração absoluta de isômeros ópticos. R,S- o sistema baseia-se na determinação da antiguidade dos substituintes no centro quiral.
A antiguidade dos substituintes é determinada pelos valores dos números atômicos dos elementos. Quanto maior o número atômico, mais velho o substituinte. Por exemplo, na molécula de bromiodoclorometano, a antiguidade dos substituintes diminui na série:

Após estabelecer a antiguidade dos substituintes, o modelo da molécula é orientado de forma que o substituinte com o menor número de série seja direcionado na direção oposta ao olho do observador. Se a antiguidade dos outros três substituintes diminui no sentido horário, então a molécula tem uma configuração denotada pela letra R (otlat, rectus - right), e se a antiguidade dos substituintes diminui no sentido anti-horário, a configuração é denotada pela letra S (lat . sinistro - esquerda). Por exemplo, para a molécula de bromiodoclorometano:

Figura 3.4. Determinação da configuração pelo sistema R,S para a molécula de bromiodoclorometano
Considere a definição da antiguidade dos substituintes e configuração para moléculas mais complexas usando o ácido lático como exemplo (Fig. 3.4). Já na primeira camada (8 O, b C, 1 H, 6 C) fica claro que o substituinte sênior é o grupo OH, e o júnior é o hidrogênio. Para determinar a precedência dos outros dois substituintes CH^ e COOH com o mesmo número atômico (6 C) na primeira camada, é necessário considerar a segunda camada. A soma dos números atômicos da segunda camada do grupo CH 3 \u003d 1 + 1 + 1 \u003d 3 e o grupo COOH \u003d 8 + 8 * 2 \u003d 24. Isso significa que o grupo COOH é mais antigo que o grupo -CH 3 diminui na série: OH > COOH > CH 3 > H


Arroz. 3.5. Determinação da configuração pelo sistema R,S para ácido lático
Racemates. Uma mistura de quantidades iguais de enantiômeros é opticamente inativa e é chamada de mistura racêmica (racemato). Os racematos diferem dos enantiômeros individuais em propriedades físicas, podem ter diferentes pontos de fusão, solubilidade; diferem em suas características espectrais.
Na prática, mais frequentemente não se trata de enantiômeros individuais, mas de racematos, que são formados como resultado de reações químicas que ocorrem com a formação de moléculas quirais.
Três métodos são usados para separar os racematos em enantiômeros:
1. Método mecânico. Como resultado da cristalização de alguns compostos opticamente ativos, duas formas de cristais podem ser formadas que são semelhantes entre si como um objeto e sua imagem espelhada. Eles podem ser separados ao microscópio com uma agulha preparativa (mecanicamente).
2. O método bioquímico baseia-se no fato de que certos tipos de microrganismos preferem uma das formas enantioméricas e a comem, a segunda permanece e pode ser facilmente isolada.
3. Método químico O método químico baseia-se na conversão de enantiômeros com a ajuda de reagentes opticamente ativos em diastereômeros, que já diferem entre si nas propriedades físicas. Os diastereômeros são muito mais fáceis de separar.
Por exemplo, uma mistura racêmica de dois ácidos (A + B) deve ser separada, para isso, uma base opticamente ativa (C) é adicionada à mistura. A reação entre a forma racêmica e a base opticamente ativa é
AC e BC são diastereômeros. Eles têm solubilidade diferente e o método de cristalização sucessiva pode isolar dois diastereômeros separadamente.
Mas como AC e BC são formados por um ácido orgânico fraco e uma base, os ácidos minerais são usados para decompô-los.

Desta forma, os enantiômeros puros A e B são obtidos.
Isomeria GEOMÉTRICA
A razão para a ocorrência de isomeria geométrica é a falta de rotação livre em torno da ligação σ. Este tipo de isomerismo é típico para compostos contendo uma ligação dupla e para compostos da série alicíclica.
Isômeros geométricos são substâncias que têm a mesma fórmula molecular, a mesma sequência de átomos de ligação nas moléculas, mas diferem entre si em um arranjo diferente de átomos ou grupos atômicos no espaço em relação ao plano da ligação dupla ou ao plano do ciclo .
A razão para o surgimento deste tipo de isomerismo é a impossibilidade de rotação livre em torno da dupla ligação ou ligações σ que formam o ciclo.
Por exemplo, buteno-2 CH 3 -CH=CH-CH 3 pode existir na forma de 2 isômeros, que diferem no arranjo dos grupos metil no espaço em relação ao plano da ligação dupla.

ou 1,2-dimetilciclopropano existe como dois isômeros que diferem no arranjo dos grupos metil no espaço em relação ao plano do anel:

O sistema cis-trans é usado para designar a configuração dos isômeros geométricos. Se os mesmos substituintes estiverem localizados no mesmo lado do plano da ligação dupla ou ciclo, a configuração é designada cis-. se em lados diferentes - trans-.
Para compostos que têm diferentes substituintes nos átomos de carbono com uma ligação dupla, a notação Z,E é usada.
O sistema Z,E é mais geral. É aplicável a isômeros geométricos com qualquer conjunto de substituintes. Este sistema é baseado na antiguidade dos substituintes, que é determinada separadamente para cada átomo de carbono. Se os substituintes seniores de cada par estiverem localizados em um lado da ligação dupla, a configuração é denotada pela letra Z (do alemão zusammen - juntos), se em lados opostos - pela letra £ (do alemão entgegen - oposto).
Assim, para 1-bromo-1-cloropropeno, dois isômeros são possíveis:

O substituinte sênior em um átomo de carbono é um grupo metil (substituintes 1 H e 6 CH 3). e o outro tem um átomo de bromo (substituintes 17 Cl e 35 Br). No isômero 1, os substituintes seniores estão localizados em um lado do plano de ligação dupla, é atribuído a configuração Z e o isômero II é a configuração E (os substituintes seniores estão localizados em lados opostos do plano de ligação dupla).
Os isômeros geométricos possuem diferentes propriedades físicas (pontos de fusão e ebulição, solubilidade, etc.), características espectrais e propriedades químicas. Essa diferença nas propriedades torna bastante fácil estabelecer sua configuração usando métodos físicos e químicos.
Isomeria de ligantes
Isomeria de ligantesé subdividida em ligação (que é determinada por diferentes tipos de coordenação do mesmo ligante) e isomerismo próprio do ligante.
A existência de nitro e nitrito-complexos de cobalto(III) de composição K 3 e K 3 podem servir como exemplos de isomerismo de ligação, em que a coordenação do ligante NO 2 - é realizada, respectivamente, através do átomo de nitrogênio ou do átomo de oxigênio. Outro exemplo é a coordenação do íon tiocianato NCS - através de um átomo de nitrogênio ou através de um átomo de enxofre, com a formação de complexos tiocianato-N- ou tiocianato-S-.
Além disso, ligantes complexos (por exemplo, aminoácidos) podem formar isômeros, cuja coordenação leva à formação de complexos da mesma composição com propriedades diferentes.
isomeria geométrica causada pela colocação desigual de ligantes na esfera interna em relação um ao outro. Uma condição necessária para o isomerismo geométrico é a presença de pelo menos dois ligantes diferentes na esfera de coordenação interna. A isomeria geométrica se manifesta principalmente em compostos complexos com estrutura octaédrica, a estrutura de um quadrado plano ou de uma pirâmide quadrada.
Compostos complexos com estrutura tetraédrica, triangular e linear não possuem isômeros geométricos, pois as localizações dos ligantes de dois tipos diferentes ao redor do átomo central são equivalentes.
Complexos com a estrutura de um quadrado plano, na presença de dois ligantes diferentes L ' e L ' , já podem ter dois isômeros (cis- e trans-):
Um exemplo de um composto complexo com isômeros cis e trans é diclorodiaminoplatina(II):
Observe que um composto complexo com estrutura quadrada plana não pode ter isômeros: a posição do ligante L'' é equiprovável em qualquer vértice do quadrado. Quando aparecem dois ligantes diferentes, já é possível a existência de dois isômeros (cis- e trans-) com propriedades diferentes. Assim, o cis-diclorodiaminoplatina (II) é um cristal amarelo-alaranjado, prontamente solúvel em água, e o trans-diclorodiaminoplatina (II) é um cristal amarelo pálido, cuja solubilidade em água é um pouco menor que a do isômero cis.
À medida que o número de ligantes diferentes na esfera interna aumenta, o número de isômeros geométricos aumenta. Para cloreto de nitro(hidroxilamina)amina(piridina)platina(II)Cl, todos os três isômeros foram obtidos:
Complexos octaédricos podem ter muitos isômeros. Se em um composto complexo desse tipo todos os seis ligantes são iguais () ou apenas um difere de todos os outros (), não há possibilidade de um arranjo diferente dos ligantes em relação um ao outro. Por exemplo, em compostos octaédricos, qualquer posição do ligante L'' em relação aos outros cinco ligantes L' será equivalente e, portanto, não deve haver isômeros aqui:
Aparência dois ligantes L' em octaédrico compostos complexos levarão à possibilidade da existência dois isômeros geométricos. Neste caso, aparecem duas maneiras diferentes de organizar os ligantes L'' um em relação ao outro. Por exemplo, o di-hidroxotetraaminocobalto(III) + cátion tem dois isômeros:
Ao tentar encontrar algum outro arranjo mútuo dos ligantes H 3 N e OH -, que seja diferente dos indicados acima, sempre chegaremos à estrutura de um dos já dados.
À medida que o número de ligantes com diferentes composições químicas aumenta no complexo, o número de isômeros geométricos aumenta rapidamente. Compostos do tipo terão quatro isômeros e compostos do tipo contendo seis ligantes diferentes terão até 15 isômeros geométricos.Tais compostos complexos ainda são pouco compreendidos.
Os isômeros geométricos diferem significativamente em propriedades físico-químicas, como cor, solubilidade, densidade, estrutura cristalina, etc.

 I. Isomerismo (do grego isos - igual) Berzelius, 1830. Isômeros são substâncias que possuem a mesma fórmula molecular (mesma composição qualitativa e quantitativa), mas diferem na sequência de átomos de ligação e (ou) seu arranjo no espaço e possuem propriedades diferentes.
I. Isomerismo (do grego isos - igual) Berzelius, 1830. Isômeros são substâncias que possuem a mesma fórmula molecular (mesma composição qualitativa e quantitativa), mas diferem na sequência de átomos de ligação e (ou) seu arranjo no espaço e possuem propriedades diferentes.
 Berzelius, Jöns Jacob 1779 - 1848 Famoso químico sueco. Desde 1807 professor de medicina e farmácia em Estocolmo.
Berzelius, Jöns Jacob 1779 - 1848 Famoso químico sueco. Desde 1807 professor de medicina e farmácia em Estocolmo.
 C 2 H 6 O éter dimetílico Tbp = -24 C álcool etílico Tbp = 78 C n-butano Tbp = -0,5 C C 4 H 10 isobutano Tbp = -11,7 C
C 2 H 6 O éter dimetílico Tbp = -24 C álcool etílico Tbp = 78 C n-butano Tbp = -0,5 C C 4 H 10 isobutano Tbp = -11,7 C
 Número de isômeros na série alcano 10 butano 2 C 14 H 30 tetradecano 1 858 C 5 H 12 pentano 3 C 15 H 32 pentadecano 4 347 C 6 H 14 hexano 5 C 20 H 42 eicosan C 7 H 16 heptano 9 C 25 H 52 pentacosano 36 797 588 C 8 H 18 octano 18 C 30 H 62 triacontano 4 111 846 763 C 9 H 20 nonano 35 C 40 H 82 tetracontano 62 491 178 805 831 C 10 H 22 decano 75 366 319
Número de isômeros na série alcano 10 butano 2 C 14 H 30 tetradecano 1 858 C 5 H 12 pentano 3 C 15 H 32 pentadecano 4 347 C 6 H 14 hexano 5 C 20 H 42 eicosan C 7 H 16 heptano 9 C 25 H 52 pentacosano 36 797 588 C 8 H 18 octano 18 C 30 H 62 triacontano 4 111 846 763 C 9 H 20 nonano 35 C 40 H 82 tetracontano 62 491 178 805 831 C 10 H 22 decano 75 366 319
 II. Homologia Grupos de compostos orgânicos do mesmo tipo de estrutura com os mesmos grupos funcionais, diferindo entre si no número de grupos -CH 2 - na cadeia carbônica, constituem uma série homóloga. Série homóloga de metano
II. Homologia Grupos de compostos orgânicos do mesmo tipo de estrutura com os mesmos grupos funcionais, diferindo entre si no número de grupos -CH 2 - na cadeia carbônica, constituem uma série homóloga. Série homóloga de metano
 III. Série isológica. l l São séries de substâncias construídas a partir do mesmo número de átomos de carbono, mas diferindo na composição quantitativa de átomos de H, ou seja, cada membro seguinte da série contém 2 átomos de H a menos que o anterior: C 2 H 6 etano C 2 H 4 etileno C 2 H 2 acetileno
III. Série isológica. l l São séries de substâncias construídas a partir do mesmo número de átomos de carbono, mas diferindo na composição quantitativa de átomos de H, ou seja, cada membro seguinte da série contém 2 átomos de H a menos que o anterior: C 2 H 6 etano C 2 H 4 etileno C 2 H 2 acetileno






 Isomeria estrutural 3. Tautomerismo (isomerismo prototrópico ou dinâmico) Tautomerismo (do grego ταύτίς - o mesmo e μέρος - medida) é o fenômeno da coexistência de duas formas isoméricas que estão em equilíbrio móvel e são capazes de se transformar espontaneamente uma na outra.
Isomeria estrutural 3. Tautomerismo (isomerismo prototrópico ou dinâmico) Tautomerismo (do grego ταύτίς - o mesmo e μέρος - medida) é o fenômeno da coexistência de duas formas isoméricas que estão em equilíbrio móvel e são capazes de se transformar espontaneamente uma na outra.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="(!LANG:Conformation >С ------- С Conformation >С ------- С
 Isomeria geométrica Isômeros geométricos - possuem a mesma ordem (sequência) de ligações na molécula, mas diferem na disposição dos átomos (grupos) no espaço em relação ao plano da ligação dupla ou ciclo pequeno.
Isomeria geométrica Isômeros geométricos - possuem a mesma ordem (sequência) de ligações na molécula, mas diferem na disposição dos átomos (grupos) no espaço em relação ao plano da ligação dupla ou ciclo pequeno.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="(!LANG: Butene-2 isômeros cis e trans Cada átomo tem >C=C cis e trans isômeros buteno- 2 Cada átomo >C=C
 "deste lado e do outro lado" do rio Leita Cisleitania - nome das terras da coroa austríaca; mostrado em vermelho; 1867 -1918 Transleitânia - o nome das terras da coroa húngara; mostrado em verde
"deste lado e do outro lado" do rio Leita Cisleitania - nome das terras da coroa austríaca; mostrado em vermelho; 1867 -1918 Transleitânia - o nome das terras da coroa húngara; mostrado em verde




 E, Z-nomenclatura 2 1 E-1 -nitro-1 -bromo-2 -cloropenteno 1 2 Z-1 -nitro-1 -bromo-2 -cloropenteno 1. Usando as regras de Kahn-Ingold-Prelog, determine a antiguidade relativa dos substituintes, ligados por uma ligação dupla e dar-lhes um número de antiguidade de 1 ou 2.
E, Z-nomenclatura 2 1 E-1 -nitro-1 -bromo-2 -cloropenteno 1 2 Z-1 -nitro-1 -bromo-2 -cloropenteno 1. Usando as regras de Kahn-Ingold-Prelog, determine a antiguidade relativa dos substituintes, ligados por uma ligação dupla e dar-lhes um número de antiguidade de 1 ou 2.
 a) Um átomo com um número atômico maior é superior a um átomo com um número menor. b) Se dois átomos são isótopos, então o átomo com o maior número de massa tem a vantagem. 2. Se os dois grupos mais antigos estiverem localizados no mesmo lado do plano de ligação π, então a configuração do substituinte é denotada pelo símbolo Z. (do alemão zusammen juntos) Se esses grupos estiverem em lados opostos do π- plano de ligação, então a configuração é denotada pelo símbolo E (do alemão entgegen oposto)
a) Um átomo com um número atômico maior é superior a um átomo com um número menor. b) Se dois átomos são isótopos, então o átomo com o maior número de massa tem a vantagem. 2. Se os dois grupos mais antigos estiverem localizados no mesmo lado do plano de ligação π, então a configuração do substituinte é denotada pelo símbolo Z. (do alemão zusammen juntos) Se esses grupos estiverem em lados opostos do π- plano de ligação, então a configuração é denotada pelo símbolo E (do alemão entgegen oposto)



 Louis Pasteur (27. 12. 1822 -28. 09. 1895) Químico francês, o maior investigador do século XIX "A assimetria é o que distingue o mundo orgânico do inorgânico" (esta lei lançou as bases da estereoquímica). Cristais assimétricos têm a propriedade de girar a luz polarizada.
Louis Pasteur (27. 12. 1822 -28. 09. 1895) Químico francês, o maior investigador do século XIX "A assimetria é o que distingue o mundo orgânico do inorgânico" (esta lei lançou as bases da estereoquímica). Cristais assimétricos têm a propriedade de girar a luz polarizada.
 Os enantiômeros são isômeros espaciais cujas moléculas se relacionam entre si como um objeto e uma imagem especular incompatível. (do grego enantios - oposto).
Os enantiômeros são isômeros espaciais cujas moléculas se relacionam entre si como um objeto e uma imagem especular incompatível. (do grego enantios - oposto).
 Quiralidade (inglês quiralidade, do grego chéir - mão), um conceito em química que caracteriza a propriedade de um objeto ser incompatível com seu reflexo em um espelho plano ideal.
Quiralidade (inglês quiralidade, do grego chéir - mão), um conceito em química que caracteriza a propriedade de um objeto ser incompatível com seu reflexo em um espelho plano ideal.






 Fischer Emil Hermann (9 de outubro de 1852, Eiskirchen - 15 de julho de 1919, Berlim), químico orgânico e bioquímico alemão.
Fischer Emil Hermann (9 de outubro de 1852, Eiskirchen - 15 de julho de 1919, Berlim), químico orgânico e bioquímico alemão.
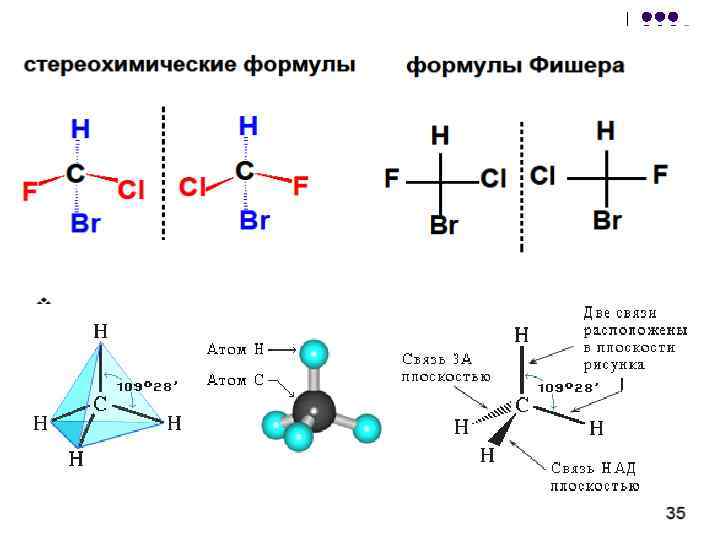


 As projeções de Fisher podem ser transformadas: l l 1. um número par de permutações de substituintes não altera a fórmula; 2. um número ímpar de permutações de substituintes leva à fórmula do antípoda (enantiômero); 3. é proibido girar a fórmula por 90 ou 270, bem como deduzir a fórmula deste plano (essas ações levam à fórmula antípoda); 4. é permitido girar toda a fórmula no plano do desenho em 180;
As projeções de Fisher podem ser transformadas: l l 1. um número par de permutações de substituintes não altera a fórmula; 2. um número ímpar de permutações de substituintes leva à fórmula do antípoda (enantiômero); 3. é proibido girar a fórmula por 90 ou 270, bem como deduzir a fórmula deste plano (essas ações levam à fórmula antípoda); 4. é permitido girar toda a fórmula no plano do desenho em 180;
 Configuração relativa 1906, por sugestão de M. A. Rozanov L- e D-isômeros (das palavras latinas laevus - esquerda e dexter - direita).
Configuração relativa 1906, por sugestão de M. A. Rozanov L- e D-isômeros (das palavras latinas laevus - esquerda e dexter - direita).



 Sistema Kahn-Ingold-Prelog? Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Grã-Bretanha) (Suíça)
Sistema Kahn-Ingold-Prelog? Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Grã-Bretanha) (Suíça)



 O número total de isômeros ópticos é determinado pela fórmula N = 2 n , n é o número de centros de quiralidade. I III IV ácido 2-amino-3-hidroxibutanóico
O número total de isômeros ópticos é determinado pela fórmula N = 2 n , n é o número de centros de quiralidade. I III IV ácido 2-amino-3-hidroxibutanóico
 Ácido tartárico I III IV eritro treo Epímeros são diastereômeros que diferem na configuração de apenas um centro assimétrico
Ácido tartárico I III IV eritro treo Epímeros são diastereômeros que diferem na configuração de apenas um centro assimétrico

 Racemate (do latim racemus - uvas). Ao misturar quantidades equimolares de D - e L - estereoisômeros, são formadas misturas opticamente inativas, que são chamadas S racêmicas (de lat. sinistro - esquerda) e R (lat. reto - direita); O racemato é indicado pelo símbolo RS. Separação de misturas racêmicas: 1. Método mecânico (método de Pasteur). 2. Método microbiológico 3. Método enzimático. 4. Método químico. Cromatografia de afinidade
Racemate (do latim racemus - uvas). Ao misturar quantidades equimolares de D - e L - estereoisômeros, são formadas misturas opticamente inativas, que são chamadas S racêmicas (de lat. sinistro - esquerda) e R (lat. reto - direita); O racemato é indicado pelo símbolo RS. Separação de misturas racêmicas: 1. Método mecânico (método de Pasteur). 2. Método microbiológico 3. Método enzimático. 4. Método químico. Cromatografia de afinidade
 INTERRELAÇÃO DA ESTRUTURA ESTEREQUÍMICA COM A MANIFESTAÇÃO DA ATIVIDADE BIOLÓGICA. Adrenalina, epinefrina IUPAC: 1 - (3, 4 -dihidroxifenil) -2 metilaminoetanol - hormônio da medula adrenal de animais e humanos. Mediador do sistema nervoso de animais de sangue frio. Dos dois enantiômeros da adrenalina, a adrenalina R(-) apresenta a maior atividade farmacológica.
INTERRELAÇÃO DA ESTRUTURA ESTEREQUÍMICA COM A MANIFESTAÇÃO DA ATIVIDADE BIOLÓGICA. Adrenalina, epinefrina IUPAC: 1 - (3, 4 -dihidroxifenil) -2 metilaminoetanol - hormônio da medula adrenal de animais e humanos. Mediador do sistema nervoso de animais de sangue frio. Dos dois enantiômeros da adrenalina, a adrenalina R(-) apresenta a maior atividade farmacológica.

 INTERRELAÇÃO DA ESTRUTURA ESTEREQUÍMICA COM A MANIFESTAÇÃO DA ATIVIDADE BIOLÓGICA. A isopropiradrenalina dextrorrotatória (Isadrine) é 800 vezes mais broncodilatadora que seu enantiômero levógiro.
INTERRELAÇÃO DA ESTRUTURA ESTEREQUÍMICA COM A MANIFESTAÇÃO DA ATIVIDADE BIOLÓGICA. A isopropiradrenalina dextrorrotatória (Isadrine) é 800 vezes mais broncodilatadora que seu enantiômero levógiro.

 Os diastereômeros são isômeros espaciais, cujas moléculas NÃO se relacionam entre si como um objeto e uma imagem especular incompatível.
Os diastereômeros são isômeros espaciais, cujas moléculas NÃO se relacionam entre si como um objeto e uma imagem especular incompatível.

 Isomeria conformacional A isomeria conformacional surge como resultado da disposição diferente de partes de uma mesma molécula em relação umas às outras, alcançada pela rotação dessas partes em torno de uma ligação simples C-C conectando dois átomos.
Isomeria conformacional A isomeria conformacional surge como resultado da disposição diferente de partes de uma mesma molécula em relação umas às outras, alcançada pela rotação dessas partes em torno de uma ligação simples C-C conectando dois átomos.
 (de lat. conformatio - forma, arranjo), várias formas espaciais assumidas por moléculas como resultado da rotação livre de fragmentos individuais em torno de ligações C-C simples.
(de lat. conformatio - forma, arranjo), várias formas espaciais assumidas por moléculas como resultado da rotação livre de fragmentos individuais em torno de ligações C-C simples.







 69% 31% Tensão de Van der Waals - devido a forças repulsivas entre grandes substituintes livres de valência.
69% 31% Tensão de Van der Waals - devido a forças repulsivas entre grandes substituintes livres de valência.