

 I. Isomerism (από το ελληνικό isos - ίσος) Berzelius, 1830. Τα ισομερή είναι ουσίες που έχουν τον ίδιο μοριακό τύπο (την ίδια ποιοτική και ποσοτική σύνθεση), αλλά διαφέρουν ως προς την αλληλουχία των ατόμων που δεσμεύουν και (ή) τη διάταξή τους στο χώρο και έχουν διαφορετικές ιδιότητες.
I. Isomerism (από το ελληνικό isos - ίσος) Berzelius, 1830. Τα ισομερή είναι ουσίες που έχουν τον ίδιο μοριακό τύπο (την ίδια ποιοτική και ποσοτική σύνθεση), αλλά διαφέρουν ως προς την αλληλουχία των ατόμων που δεσμεύουν και (ή) τη διάταξή τους στο χώρο και έχουν διαφορετικές ιδιότητες.
 Berzelius, Jöns Jacob 1779 - 1848 Διάσημος Σουηδός χημικός. Από το 1807 καθηγητής ιατρικής και φαρμακευτικής στη Στοκχόλμη.
Berzelius, Jöns Jacob 1779 - 1848 Διάσημος Σουηδός χημικός. Από το 1807 καθηγητής ιατρικής και φαρμακευτικής στη Στοκχόλμη.
 C 2 H 6 O διμεθυλαιθέρας Tbp = -24 C αιθυλική αλκοόλη Tbp = 78 C n-βουτάνιο Tbp = -0,5 C C 4 H 10 ισοβουτάνιο Tbp = -11,7 C
C 2 H 6 O διμεθυλαιθέρας Tbp = -24 C αιθυλική αλκοόλη Tbp = 78 C n-βουτάνιο Tbp = -0,5 C C 4 H 10 ισοβουτάνιο Tbp = -11,7 C
 Αριθμός ισομερών στη σειρά αλκανίων 10 βουτάνιο 2 C 14 H 30 τετραδεκάνιο 1 858 C 5 H 12 πεντάνιο 3 C 15 H 32 πενταδεκάνιο 4 347 C 6 H 14 εξάνιο 5 C 20 H 42 εικοζάνη C 25 H 7 H 52 pentacosane 36 797 588 C 8 H 18 octane 18 C 30 H 62 triacontane 4 111 846 763 C 9 H 20 nonane 35 C 40 H 82 tetracontane 62 491 0161 178
Αριθμός ισομερών στη σειρά αλκανίων 10 βουτάνιο 2 C 14 H 30 τετραδεκάνιο 1 858 C 5 H 12 πεντάνιο 3 C 15 H 32 πενταδεκάνιο 4 347 C 6 H 14 εξάνιο 5 C 20 H 42 εικοζάνη C 25 H 7 H 52 pentacosane 36 797 588 C 8 H 18 octane 18 C 30 H 62 triacontane 4 111 846 763 C 9 H 20 nonane 35 C 40 H 82 tetracontane 62 491 0161 178
 II. Ομολογία Ομάδες οργανικών ενώσεων του ίδιου τύπου δομής με τις ίδιες λειτουργικές ομάδες, που διαφέρουν μεταξύ τους ως προς τον αριθμό των ομάδων -CH 2 - στην ανθρακική αλυσίδα, συνιστούν μια ομόλογη σειρά. Ομόλογη σειρά μεθανίου
II. Ομολογία Ομάδες οργανικών ενώσεων του ίδιου τύπου δομής με τις ίδιες λειτουργικές ομάδες, που διαφέρουν μεταξύ τους ως προς τον αριθμό των ομάδων -CH 2 - στην ανθρακική αλυσίδα, συνιστούν μια ομόλογη σειρά. Ομόλογη σειρά μεθανίου
 III. Ισολογικές γραμμές. l l Πρόκειται για σειρές ουσιών που κατασκευάζονται από τον ίδιο αριθμό ατόμων άνθρακα, αλλά διαφέρουν στην ποσοτική σύνθεση των ατόμων Η, δηλαδή κάθε επόμενο μέλος της σειράς περιέχει 2 άτομα Η λιγότερα από το προηγούμενο: C 2 H 6 αιθάνιο C 2 H 4 αιθυλένιο C 2 H 2 ακετυλένιο
III. Ισολογικές γραμμές. l l Πρόκειται για σειρές ουσιών που κατασκευάζονται από τον ίδιο αριθμό ατόμων άνθρακα, αλλά διαφέρουν στην ποσοτική σύνθεση των ατόμων Η, δηλαδή κάθε επόμενο μέλος της σειράς περιέχει 2 άτομα Η λιγότερα από το προηγούμενο: C 2 H 6 αιθάνιο C 2 H 4 αιθυλένιο C 2 H 2 ακετυλένιο






 Δομική ισομέρεια 3. Ταυτομερισμός (πρωτότροπος ή δυναμικός ισομερισμός) Ταυτομερισμός (από το ελληνικό ταύτις - το ίδιο και μέρος - μέτρο) είναι το φαινόμενο της συνύπαρξης δύο ισομερών μορφών που βρίσκονται σε κινητική ισορροπία και μπορούν να μετασχηματίζονται αυθόρμητα η μια στην άλλη.
Δομική ισομέρεια 3. Ταυτομερισμός (πρωτότροπος ή δυναμικός ισομερισμός) Ταυτομερισμός (από το ελληνικό ταύτις - το ίδιο και μέρος - μέτρο) είναι το φαινόμενο της συνύπαρξης δύο ισομερών μορφών που βρίσκονται σε κινητική ισορροπία και μπορούν να μετασχηματίζονται αυθόρμητα η μια στην άλλη.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="(!LANG:Conformation >С ------- С Conformation >С ------- С
 Γεωμετρική ισομέρεια Γεωμετρικά ισομερή - έχουν την ίδια σειρά (αλληλουχία) δεσμών στο μόριο, αλλά διαφέρουν ως προς τη διάταξη των ατόμων (ομάδων) στο χώρο σε σχέση με το επίπεδο του διπλού δεσμού ή του μικρού κύκλου.
Γεωμετρική ισομέρεια Γεωμετρικά ισομερή - έχουν την ίδια σειρά (αλληλουχία) δεσμών στο μόριο, αλλά διαφέρουν ως προς τη διάταξη των ατόμων (ομάδων) στο χώρο σε σχέση με το επίπεδο του διπλού δεσμού ή του μικρού κύκλου.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="(!LANG: Βουτένιο-2 cis και trans ισομερή Κάθε άτομο έχει >C=C cis και trans ισομερή βουτένιο- 2 Κάθε άτομο >C=C
 "σε αυτήν την πλευρά και από την άλλη πλευρά" του ποταμού Leita Cisleitania - το όνομα των εδαφών του αυστριακού στέμματος. φαίνεται με κόκκινο? 1867 -1918 Transleitania - το όνομα των εδαφών του ουγγρικού στέμματος. φαίνεται με πράσινο χρώμα
"σε αυτήν την πλευρά και από την άλλη πλευρά" του ποταμού Leita Cisleitania - το όνομα των εδαφών του αυστριακού στέμματος. φαίνεται με κόκκινο? 1867 -1918 Transleitania - το όνομα των εδαφών του ουγγρικού στέμματος. φαίνεται με πράσινο χρώμα




 E, Z-ονοματολογία 2 1 E-1 -nitro-1 -bromo-2 -chloropentene 1 2 Z-1 -nitro-1 -bromo-2 -chloropentene 1. Χρησιμοποιώντας τους κανόνες Kahn-Ingold-Prelog, προσδιορίστε τη σχετική αρχαιότητα των υποκαταστατών, συνδέονται με διπλό δεσμό και τους δίνουν αριθμό αρχαιότητας 1 ή 2.
E, Z-ονοματολογία 2 1 E-1 -nitro-1 -bromo-2 -chloropentene 1 2 Z-1 -nitro-1 -bromo-2 -chloropentene 1. Χρησιμοποιώντας τους κανόνες Kahn-Ingold-Prelog, προσδιορίστε τη σχετική αρχαιότητα των υποκαταστατών, συνδέονται με διπλό δεσμό και τους δίνουν αριθμό αρχαιότητας 1 ή 2.
 α) Ένα άτομο με μεγαλύτερο ατομικό αριθμό είναι ανώτερο από ένα άτομο με μικρότερο αριθμό. β) Αν δύο άτομα είναι ισότοπα, τότε το άτομο με τον μεγαλύτερο μαζικό αριθμό έχει το πλεονέκτημα. 2. Εάν οι δύο πιο ανώτερες ομάδες βρίσκονται στην ίδια πλευρά του επιπέδου π-δεσμού, τότε η διαμόρφωση του υποκαταστάτη συμβολίζεται με το σύμβολο Z. (από το γερμανικό zusammen μαζί) Εάν αυτές οι ομάδες βρίσκονται στις αντίθετες πλευρές του π- επίπεδο δεσμού, τότε η διαμόρφωση συμβολίζεται με το σύμβολο E (από το γερμανικό entgegen απέναντι)
α) Ένα άτομο με μεγαλύτερο ατομικό αριθμό είναι ανώτερο από ένα άτομο με μικρότερο αριθμό. β) Αν δύο άτομα είναι ισότοπα, τότε το άτομο με τον μεγαλύτερο μαζικό αριθμό έχει το πλεονέκτημα. 2. Εάν οι δύο πιο ανώτερες ομάδες βρίσκονται στην ίδια πλευρά του επιπέδου π-δεσμού, τότε η διαμόρφωση του υποκαταστάτη συμβολίζεται με το σύμβολο Z. (από το γερμανικό zusammen μαζί) Εάν αυτές οι ομάδες βρίσκονται στις αντίθετες πλευρές του π- επίπεδο δεσμού, τότε η διαμόρφωση συμβολίζεται με το σύμβολο E (από το γερμανικό entgegen απέναντι)



 Louis Pasteur (27. 12. 1822 -28. 09. 1895) Γάλλος χημικός, ο μεγαλύτερος ερευνητής του 19ου αιώνα «Η ασυμμετρία είναι αυτή που διακρίνει τον οργανικό κόσμο από τον ανόργανο» (αυτός ο νόμος έθεσε τα θεμέλια για τη στερεοχημεία). Οι ασύμμετροι κρύσταλλοι έχουν την ιδιότητα του περιστρεφόμενου πολωμένου φωτός.
Louis Pasteur (27. 12. 1822 -28. 09. 1895) Γάλλος χημικός, ο μεγαλύτερος ερευνητής του 19ου αιώνα «Η ασυμμετρία είναι αυτή που διακρίνει τον οργανικό κόσμο από τον ανόργανο» (αυτός ο νόμος έθεσε τα θεμέλια για τη στερεοχημεία). Οι ασύμμετροι κρύσταλλοι έχουν την ιδιότητα του περιστρεφόμενου πολωμένου φωτός.
 Τα εναντιομερή είναι χωρικά ισομερή των οποίων τα μόρια σχετίζονται μεταξύ τους ως αντικείμενο και ως ασύμβατη κατοπτρική εικόνα. (από τα ελληνικά ενάντιος - απέναντι).
Τα εναντιομερή είναι χωρικά ισομερή των οποίων τα μόρια σχετίζονται μεταξύ τους ως αντικείμενο και ως ασύμβατη κατοπτρική εικόνα. (από τα ελληνικά ενάντιος - απέναντι).
 Χειρικότητα (αγγλ. chirality, από το ελληνικό chéir - χέρι), μια έννοια στη χημεία που χαρακτηρίζει την ιδιότητα ενός αντικειμένου να είναι ασύμβατο με την αντανάκλασή του σε έναν ιδανικό επίπεδο καθρέφτη.
Χειρικότητα (αγγλ. chirality, από το ελληνικό chéir - χέρι), μια έννοια στη χημεία που χαρακτηρίζει την ιδιότητα ενός αντικειμένου να είναι ασύμβατο με την αντανάκλασή του σε έναν ιδανικό επίπεδο καθρέφτη.






 Fischer Emil Hermann (9 Οκτωβρίου 1852, Eiskirchen - 15 Ιουλίου 1919, Βερολίνο), Γερμανός οργανικός χημικός και βιοχημικός.
Fischer Emil Hermann (9 Οκτωβρίου 1852, Eiskirchen - 15 Ιουλίου 1919, Βερολίνο), Γερμανός οργανικός χημικός και βιοχημικός.


 Οι προβολές Fisher μπορούν να μετασχηματιστούν: l l 1. ένας ζυγός αριθμός μεταθέσεων υποκαταστατών δεν αλλάζει τον τύπο. 2. ένας περιττός αριθμός μεταθέσεων υποκαταστατών οδηγεί στον τύπο του αντίποδα (εναντιομερές). 3. Απαγορεύεται η περιστροφή του τύπου κατά 90 ή 270, καθώς και η εξαγωγή του τύπου από αυτό το επίπεδο (αυτές οι ενέργειες οδηγούν στον τύπο του αντίποδα). 4. Επιτρέπεται η περιστροφή ολόκληρου του τύπου στο επίπεδο του σχεδίου κατά 180.
Οι προβολές Fisher μπορούν να μετασχηματιστούν: l l 1. ένας ζυγός αριθμός μεταθέσεων υποκαταστατών δεν αλλάζει τον τύπο. 2. ένας περιττός αριθμός μεταθέσεων υποκαταστατών οδηγεί στον τύπο του αντίποδα (εναντιομερές). 3. Απαγορεύεται η περιστροφή του τύπου κατά 90 ή 270, καθώς και η εξαγωγή του τύπου από αυτό το επίπεδο (αυτές οι ενέργειες οδηγούν στον τύπο του αντίποδα). 4. Επιτρέπεται η περιστροφή ολόκληρου του τύπου στο επίπεδο του σχεδίου κατά 180.
 Σχετική διαμόρφωση 1906, μετά από πρόταση του M. A. Rozanov L- και D-ισομερή (από τις λατινικές λέξεις laevus - αριστερά και dexter - δεξιά).
Σχετική διαμόρφωση 1906, μετά από πρόταση του M. A. Rozanov L- και D-ισομερή (από τις λατινικές λέξεις laevus - αριστερά και dexter - δεξιά).



 Σύστημα Kahn-Ingold-Prelog; Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Μεγάλη Βρετανία) (Ελβετία)
Σύστημα Kahn-Ingold-Prelog; Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Μεγάλη Βρετανία) (Ελβετία)



 Ο συνολικός αριθμός των οπτικών ισομερών καθορίζεται από τον τύπο N = 2 n, n είναι ο αριθμός των κέντρων χειραλικότητας. I III IV 2-αμινο-3-υδροξυβουτανοϊκό οξύ
Ο συνολικός αριθμός των οπτικών ισομερών καθορίζεται από τον τύπο N = 2 n, n είναι ο αριθμός των κέντρων χειραλικότητας. I III IV 2-αμινο-3-υδροξυβουτανοϊκό οξύ
 Τρυγικό οξύ I III IV erythro threo Τα επιμερή είναι διαστερεομερή που διαφέρουν ως προς τη διαμόρφωση ενός μόνο ασύμμετρου κέντρου
Τρυγικό οξύ I III IV erythro threo Τα επιμερή είναι διαστερεομερή που διαφέρουν ως προς τη διαμόρφωση ενός μόνο ασύμμετρου κέντρου

 Racemate (από το λατινικό racemus - σταφύλια). Κατά την ανάμειξη ισομοριακών ποσοτήτων στερεοϊσομερών D - και L - σχηματίζονται οπτικά ανενεργά μίγματα, τα οποία ονομάζονται ρακεμικά S (από λατ. sinister - αριστερά) και R (lat. rectus - δεξιά). Το ρακεμικό υποδηλώνεται με το σύμβολο RS. Διάσπαση ρακεμικών μιγμάτων: 1. Μηχανική μέθοδος (μέθοδος Παστέρ). 2. Μικροβιολογική μέθοδος 3. Ενζυματική μέθοδος. 4. Χημική μέθοδος. χρωματογραφία συγγένειας
Racemate (από το λατινικό racemus - σταφύλια). Κατά την ανάμειξη ισομοριακών ποσοτήτων στερεοϊσομερών D - και L - σχηματίζονται οπτικά ανενεργά μίγματα, τα οποία ονομάζονται ρακεμικά S (από λατ. sinister - αριστερά) και R (lat. rectus - δεξιά). Το ρακεμικό υποδηλώνεται με το σύμβολο RS. Διάσπαση ρακεμικών μιγμάτων: 1. Μηχανική μέθοδος (μέθοδος Παστέρ). 2. Μικροβιολογική μέθοδος 3. Ενζυματική μέθοδος. 4. Χημική μέθοδος. χρωματογραφία συγγένειας
 ΣΧΕΣΗ ΤΗΣ ΣΤΕΡΕΟΧΗΜΙΚΗΣ ΔΟΜΗΣ ΜΕ ΤΗΝ ΕΚΔΗΛΩΣΗ ΤΗΣ ΒΙΟΛΟΓΙΚΗΣ ΔΡΑΣΤΗΡΙΟΤΗΤΑΣ. Αδρεναλίνη, επινεφρίνη IUPAC: 1 - (3, 4 -διυδροξυφαινυλ) -2 μεθυλαμινοαιθανόλη - ορμόνη του μυελού των επινεφριδίων ζώων και ανθρώπων. Μεσολαβητής του νευρικού συστήματος των ψυχρόαιμων ζώων. Από τα δύο εναντιομερή της αδρεναλίνης, η R (-) αδρεναλίνη εμφανίζει την υψηλότερη φαρμακολογική δράση.
ΣΧΕΣΗ ΤΗΣ ΣΤΕΡΕΟΧΗΜΙΚΗΣ ΔΟΜΗΣ ΜΕ ΤΗΝ ΕΚΔΗΛΩΣΗ ΤΗΣ ΒΙΟΛΟΓΙΚΗΣ ΔΡΑΣΤΗΡΙΟΤΗΤΑΣ. Αδρεναλίνη, επινεφρίνη IUPAC: 1 - (3, 4 -διυδροξυφαινυλ) -2 μεθυλαμινοαιθανόλη - ορμόνη του μυελού των επινεφριδίων ζώων και ανθρώπων. Μεσολαβητής του νευρικού συστήματος των ψυχρόαιμων ζώων. Από τα δύο εναντιομερή της αδρεναλίνης, η R (-) αδρεναλίνη εμφανίζει την υψηλότερη φαρμακολογική δράση.

 ΣΧΕΣΗ ΤΗΣ ΣΤΕΡΕΟΧΗΜΙΚΗΣ ΔΟΜΗΣ ΜΕ ΤΗΝ ΕΚΔΗΛΩΣΗ ΤΗΣ ΒΙΟΛΟΓΙΚΗΣ ΔΡΑΣΤΗΡΙΟΤΗΤΑΣ. Η δεξιοστροφική ισοπροπυραδρεναλίνη (Isadrine) είναι 800 φορές πιο βρογχοδιασταλτική από το αριστερόστροφο εναντιομερές της.
ΣΧΕΣΗ ΤΗΣ ΣΤΕΡΕΟΧΗΜΙΚΗΣ ΔΟΜΗΣ ΜΕ ΤΗΝ ΕΚΔΗΛΩΣΗ ΤΗΣ ΒΙΟΛΟΓΙΚΗΣ ΔΡΑΣΤΗΡΙΟΤΗΤΑΣ. Η δεξιοστροφική ισοπροπυραδρεναλίνη (Isadrine) είναι 800 φορές πιο βρογχοδιασταλτική από το αριστερόστροφο εναντιομερές της.

 Τα διαστερεομερή είναι χωρικά ισομερή, τα μόρια των οποίων ΔΕΝ σχετίζονται μεταξύ τους ως αντικείμενο και ως ασυμβίβαστο κατοπτρικό είδωλο.
Τα διαστερεομερή είναι χωρικά ισομερή, τα μόρια των οποίων ΔΕΝ σχετίζονται μεταξύ τους ως αντικείμενο και ως ασυμβίβαστο κατοπτρικό είδωλο.

 Διαμόρφωση ισομέρεια Η διαμορφωτική ισομέρεια προκύπτει ως αποτέλεσμα της διαφορετικής διάταξης μερών του ίδιου μορίου μεταξύ τους, που επιτυγχάνεται με την περιστροφή αυτών των τμημάτων γύρω από έναν απλό δεσμό C-C που συνδέει δύο άτομα.
Διαμόρφωση ισομέρεια Η διαμορφωτική ισομέρεια προκύπτει ως αποτέλεσμα της διαφορετικής διάταξης μερών του ίδιου μορίου μεταξύ τους, που επιτυγχάνεται με την περιστροφή αυτών των τμημάτων γύρω από έναν απλό δεσμό C-C που συνδέει δύο άτομα.
 (από το λατ. conformatio - σχήμα, διάταξη), διάφορες χωρικές μορφές που λαμβάνονται από μόρια ως αποτέλεσμα ελεύθερης περιστροφής μεμονωμένων θραυσμάτων γύρω από απλούς δεσμούς C-C.
(από το λατ. conformatio - σχήμα, διάταξη), διάφορες χωρικές μορφές που λαμβάνονται από μόρια ως αποτέλεσμα ελεύθερης περιστροφής μεμονωμένων θραυσμάτων γύρω από απλούς δεσμούς C-C.







 69% 31% τάση Van der Waals - λόγω απωστικών δυνάμεων μεταξύ μεγάλων υποκαταστατών χωρίς σθένος.
69% 31% τάση Van der Waals - λόγω απωστικών δυνάμεων μεταξύ μεγάλων υποκαταστατών χωρίς σθένος.
Κατά τη διάρκεια του μαθήματος, θα πάρετε μια γενική ιδέα για τους τύπους ισομερισμού, θα μάθετε τι είναι το ισομερές. Μάθετε για τους τύπους ισομέρειας στην οργανική χημεία: δομικό και χωρικό (στερεοϊσομέρεια). Χρησιμοποιώντας τους συντακτικούς τύπους των ουσιών, εξετάστε τα υποείδη της δομικής ισομέρειας (σκελετική και ισομέρεια θέσης), μάθετε για τις ποικιλίες χωρικής ισομέρειας: γεωμετρική και οπτική.
Θέμα: Εισαγωγή στην οργανική χημεία
Μάθημα: Ισομέρεια. Τύποι ισομερισμού. Δομική ισομέρεια, γεωμετρική, οπτική
Οι τύποι τύπων που εξετάσαμε νωρίτερα, περιγράφοντας οργανικές ουσίες, δείχνουν ότι πολλοί διαφορετικοί δομικοί τύποι μπορούν να αντιστοιχούν σε έναν μοριακό τύπο.
Για παράδειγμα, ο μοριακός τύπος Γ2H6Οανταποκρίνομαι δύο ουσίεςμε διαφορετικούς δομικούς τύπους - αιθυλική αλκοόλη και διμεθυλαιθέρας. Ρύζι. ένας.
Η αιθυλική αλκοόλη, ένα υγρό που αντιδρά με μεταλλικό νάτριο για να απελευθερώσει υδρογόνο, βράζει στους +78,5 0 C. Υπό τις ίδιες συνθήκες, ο διμεθυλαιθέρας, ένα αέριο που δεν αντιδρά με το νάτριο, βράζει στους -23 0 C.
Αυτές οι ουσίες διαφέρουν ως προς τη δομή τους - διαφορετικές ουσίες αντιστοιχούν στον ίδιο μοριακό τύπο.
Ρύζι. 1. Διαταξική ισομέρεια
Το φαινόμενο της ύπαρξης ουσιών που έχουν την ίδια σύνθεση, αλλά διαφορετική δομή και επομένως διαφορετικές ιδιότητες, ονομάζεται ισομερισμός (από τις ελληνικές λέξεις «ίσος» - «ίσος» και «μέρος» - «μέρος», «μερίδιο»).
Τύποι ισομερισμού
Υπάρχουν διάφοροι τύποι ισομερισμού.
Ο δομικός ισομερισμός σχετίζεται με διαφορετική σειρά σύνδεσης ατόμων σε ένα μόριο.
Η αιθανόλη και ο διμεθυλαιθέρας είναι δομικά ισομερή. Δεδομένου ότι ανήκουν σε διαφορετικές κατηγορίες οργανικών ενώσεων, αυτός ο τύπος δομικής ισομέρειας ονομάζεται επίσης διαταξικό . Ρύζι. ένας.
Τα δομικά ισομερή μπορούν επίσης να ανήκουν στην ίδια κατηγορία ενώσεων, για παράδειγμα, ο τύπος C 5 H 12 αντιστοιχεί σε τρεις διαφορετικούς υδρογονάνθρακες. το ισομέρεια του ανθρακικού σκελετού. Ρύζι. 2.

Ρύζι. 2 Παραδείγματα ουσιών - δομικά ισομερή
Υπάρχουν δομικά ισομερή με τον ίδιο σκελετό άνθρακα, τα οποία διαφέρουν ως προς τη θέση πολλαπλών δεσμών (διπλών και τριπλών) ή ατόμων που αντικαθιστούν το υδρογόνο. Αυτό το είδος δομικής ισομέρειας ονομάζεται ισομέρεια θέσης.
Ρύζι. 3. Ισομέρεια δομικής θέσης
Σε μόρια που περιέχουν μόνο απλούς δεσμούς, η σχεδόν ελεύθερη περιστροφή των θραυσμάτων του μορίου γύρω από τους δεσμούς είναι δυνατή σε θερμοκρασία δωματίου και, για παράδειγμα, όλες οι εικόνες των τύπων του 1,2-διχλωροαιθανίου είναι ισοδύναμες. Ρύζι. τέσσερα

Ρύζι. 4. Θέση των ατόμων χλωρίου γύρω από έναν απλό δεσμό
Εάν η περιστροφή είναι δύσκολη, για παράδειγμα, σε ένα κυκλικό μόριο ή με διπλό δεσμό, τότε γεωμετρική ή cis-trans ισομέρεια.Στα cis ισομερή, οι υποκαταστάτες βρίσκονται στην ίδια πλευρά του επιπέδου δακτυλίου ή του διπλού δεσμού, στα trans ισομερή βρίσκονται σε αντίθετες πλευρές.
Cis-trans ισομερή υπάρχουν όταν δύο διαφορετικάαναπληρωτής. Ρύζι. 5.



Ρύζι. 5. Ισομερή Cis και trans
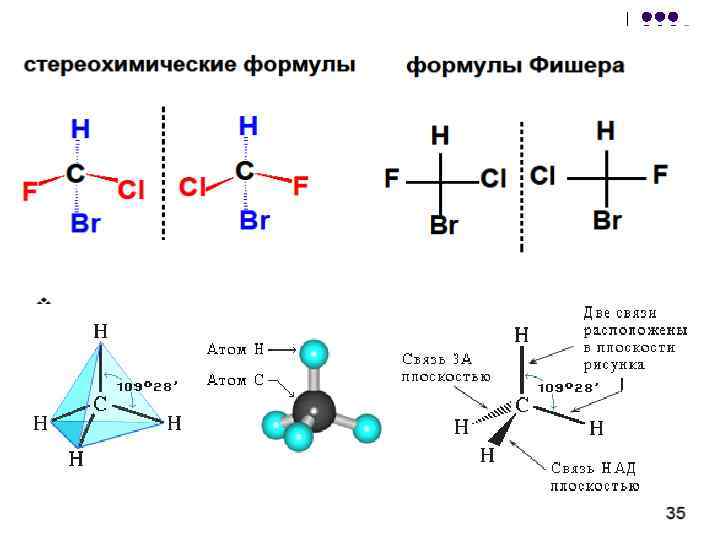
Ένας άλλος τύπος ισομερισμού προκύπτει λόγω του γεγονότος ότι ένα άτομο άνθρακα με τέσσερις απλούς δεσμούς σχηματίζει με τους υποκαταστάτες του μια χωρική δομή - ένα τετράεδρο. Εάν ένα μόριο έχει τουλάχιστον ένα άτομο άνθρακα συνδεδεμένο με τέσσερις διαφορετικούς υποκαταστάτες, οπτική ισομέρεια. Τέτοια μόρια δεν συμπίπτουν με την κατοπτρική τους εικόνα. Αυτή η ιδιότητα ονομάζεται χειραλικότητα - από τα ελληνικά Μειερέως- "χέρι". Ρύζι. 6. Ο οπτικός ισομερισμός είναι χαρακτηριστικός πολλών μορίων που αποτελούν τους ζωντανούς οργανισμούς.
|
|
|
Ρύζι. 6. Παραδείγματα οπτικών ισομερών
Οπτική ισομέρεια ονομάζεται επίσης εναντιομερή (από τα ελληνικά εναντιος- «απέναντι» και μέρος- "μέρος"), και οπτικά ισομερή - εναντιομερή . Τα εναντιομερή είναι οπτικά ενεργά, περιστρέφουν το επίπεδο πόλωσης του φωτός με την ίδια γωνία, αλλά σε αντίθετες κατευθύνσεις: ρε- , ή (+)-ισομερές, - προς τα δεξιά, μεγάλο- , ή (-)-ισομερές, - προς τα αριστερά. Ένα μείγμα ίσων ποσοτήτων εναντιομερών ονομάζεται ρακεμικό, είναι οπτικά ανενεργό και συμβολίζεται με το σύμβολο δ, λ- ή (±).
Συνοψίζοντας το μάθημα
Κατά τη διάρκεια του μαθήματος, αποκτήσατε μια γενική ιδέα για τους τύπους ισομερισμού, τι είναι ισομερές. Έμαθε για τους τύπους ισομέρειας στην οργανική χημεία: δομικό και χωρικό (στερεοϊσομέρεια). Με τη βοήθεια των δομικών τύπων των ουσιών, εξετάσαμε υποείδη δομικής ισομέρειας (σκελετική και ισομέρεια θέσης), εξοικειωθήκαμε με τις ποικιλίες χωρικής ισομέρειας: γεωμετρική και οπτική.
Βιβλιογραφία
1. Ρουτζίτης Γ.Ε. Χημεία. Βασικές αρχές Γενικής Χημείας. 10η τάξη: εγχειρίδιο για εκπαιδευτικά ιδρύματα: βασικό επίπεδο / Γ. Ε. Ρουτζίτης, Φ.Γ. Φέλντμαν. - 14η έκδοση. - Μ.: Εκπαίδευση, 2012.
2. Χημεία. Βαθμός 10. Επίπεδο προφίλ: σχολικό βιβλίο. για τη γενική εκπαίδευση ιδρύματα / V.V. Eremin, Ν.Ε. Kuzmenko, V.V. Lunin και άλλοι - Μ.: Δρόφα, 2008. - 463 σελ.
3. Χημεία. Βαθμός 11. Επίπεδο προφίλ: σχολικό βιβλίο. για τη γενική εκπαίδευση ιδρύματα / V.V. Eremin, Ν.Ε. Kuzmenko, V.V. Lunin και άλλοι - Μ.: Δρόφα, 2010. - 462 σελ.
4. Khomchenko G.P., Khomchenko I.G. Συλλογή προβλημάτων στη χημεία για όσους εισέρχονται στα πανεπιστήμια. - 4η έκδ. - M.: RIA "New Wave": Εκδότης Umerenkov, 2012. - 278 σελ.
Εργασία για το σπίτι
1. Αρ. 1,2 (σελ. 39) Ρουτζίτης Γ.Ε. Χημεία. Βασικές αρχές Γενικής Χημείας. 10η τάξη: εγχειρίδιο για εκπαιδευτικά ιδρύματα: βασικό επίπεδο / Γ. Ε. Ρουτζίτης, Φ.Γ. Φέλντμαν. - 14η έκδοση. - Μ.: Εκπαίδευση, 2012.
2. Γιατί ο αριθμός των ισομερών στους υδρογονάνθρακες της σειράς του αιθυλενίου είναι μεγαλύτερος από αυτόν των κορεσμένων υδρογονανθράκων;
3. Ποιοι υδρογονάνθρακες έχουν χωρικά ισομερή;
Κατά τη διάρκεια του μαθήματος, θα πάρετε μια γενική ιδέα για τους τύπους ισομερισμού, θα μάθετε τι είναι το ισομερές. Μάθετε για τους τύπους ισομέρειας στην οργανική χημεία: δομικό και χωρικό (στερεοϊσομέρεια). Χρησιμοποιώντας τους συντακτικούς τύπους των ουσιών, εξετάστε τα υποείδη της δομικής ισομέρειας (σκελετική και ισομέρεια θέσης), μάθετε για τις ποικιλίες χωρικής ισομέρειας: γεωμετρική και οπτική.
Θέμα: Εισαγωγή στην οργανική χημεία
Μάθημα: Ισομέρεια. Τύποι ισομερισμού. Δομική ισομέρεια, γεωμετρική, οπτική
Οι τύποι τύπων που εξετάσαμε νωρίτερα, περιγράφοντας οργανικές ουσίες, δείχνουν ότι πολλοί διαφορετικοί δομικοί τύποι μπορούν να αντιστοιχούν σε έναν μοριακό τύπο.
Για παράδειγμα, ο μοριακός τύπος Γ2H6Οανταποκρίνομαι δύο ουσίεςμε διαφορετικούς δομικούς τύπους - αιθυλική αλκοόλη και διμεθυλαιθέρας. Ρύζι. ένας.
Η αιθυλική αλκοόλη, ένα υγρό που αντιδρά με μεταλλικό νάτριο για να απελευθερώσει υδρογόνο, βράζει στους +78,5 0 C. Υπό τις ίδιες συνθήκες, ο διμεθυλαιθέρας, ένα αέριο που δεν αντιδρά με το νάτριο, βράζει στους -23 0 C.
Αυτές οι ουσίες διαφέρουν ως προς τη δομή τους - διαφορετικές ουσίες αντιστοιχούν στον ίδιο μοριακό τύπο.
Ρύζι. 1. Διαταξική ισομέρεια
Το φαινόμενο της ύπαρξης ουσιών που έχουν την ίδια σύνθεση, αλλά διαφορετική δομή και επομένως διαφορετικές ιδιότητες, ονομάζεται ισομερισμός (από τις ελληνικές λέξεις «ίσος» - «ίσος» και «μέρος» - «μέρος», «μερίδιο»).
Τύποι ισομερισμού
Υπάρχουν διάφοροι τύποι ισομερισμού.
Ο δομικός ισομερισμός σχετίζεται με διαφορετική σειρά σύνδεσης ατόμων σε ένα μόριο.
Η αιθανόλη και ο διμεθυλαιθέρας είναι δομικά ισομερή. Δεδομένου ότι ανήκουν σε διαφορετικές κατηγορίες οργανικών ενώσεων, αυτός ο τύπος δομικής ισομέρειας ονομάζεται επίσης διαταξικό . Ρύζι. ένας.
Τα δομικά ισομερή μπορούν επίσης να ανήκουν στην ίδια κατηγορία ενώσεων, για παράδειγμα, ο τύπος C 5 H 12 αντιστοιχεί σε τρεις διαφορετικούς υδρογονάνθρακες. το ισομέρεια του ανθρακικού σκελετού. Ρύζι. 2.

Ρύζι. 2 Παραδείγματα ουσιών - δομικά ισομερή
Υπάρχουν δομικά ισομερή με τον ίδιο σκελετό άνθρακα, τα οποία διαφέρουν ως προς τη θέση πολλαπλών δεσμών (διπλών και τριπλών) ή ατόμων που αντικαθιστούν το υδρογόνο. Αυτό το είδος δομικής ισομέρειας ονομάζεται ισομέρεια θέσης.
Ρύζι. 3. Ισομέρεια δομικής θέσης
Σε μόρια που περιέχουν μόνο απλούς δεσμούς, η σχεδόν ελεύθερη περιστροφή των θραυσμάτων του μορίου γύρω από τους δεσμούς είναι δυνατή σε θερμοκρασία δωματίου και, για παράδειγμα, όλες οι εικόνες των τύπων του 1,2-διχλωροαιθανίου είναι ισοδύναμες. Ρύζι. τέσσερα

Ρύζι. 4. Θέση των ατόμων χλωρίου γύρω από έναν απλό δεσμό
Εάν η περιστροφή είναι δύσκολη, για παράδειγμα, σε ένα κυκλικό μόριο ή με διπλό δεσμό, τότε γεωμετρική ή cis-trans ισομέρεια.Στα cis ισομερή, οι υποκαταστάτες βρίσκονται στην ίδια πλευρά του επιπέδου δακτυλίου ή του διπλού δεσμού, στα trans ισομερή βρίσκονται σε αντίθετες πλευρές.
Cis-trans ισομερή υπάρχουν όταν δύο διαφορετικάαναπληρωτής. Ρύζι. 5.



Ρύζι. 5. Ισομερή Cis και trans
Ένας άλλος τύπος ισομερισμού προκύπτει λόγω του γεγονότος ότι ένα άτομο άνθρακα με τέσσερις απλούς δεσμούς σχηματίζει με τους υποκαταστάτες του μια χωρική δομή - ένα τετράεδρο. Εάν ένα μόριο έχει τουλάχιστον ένα άτομο άνθρακα συνδεδεμένο με τέσσερις διαφορετικούς υποκαταστάτες, οπτική ισομέρεια. Τέτοια μόρια δεν συμπίπτουν με την κατοπτρική τους εικόνα. Αυτή η ιδιότητα ονομάζεται χειραλικότητα - από τα ελληνικά Μειερέως- "χέρι". Ρύζι. 6. Ο οπτικός ισομερισμός είναι χαρακτηριστικός πολλών μορίων που αποτελούν τους ζωντανούς οργανισμούς.
|
|
|
Ρύζι. 6. Παραδείγματα οπτικών ισομερών
Οπτική ισομέρεια ονομάζεται επίσης εναντιομερή (από τα ελληνικά εναντιος- «απέναντι» και μέρος- "μέρος"), και οπτικά ισομερή - εναντιομερή . Τα εναντιομερή είναι οπτικά ενεργά, περιστρέφουν το επίπεδο πόλωσης του φωτός με την ίδια γωνία, αλλά σε αντίθετες κατευθύνσεις: ρε- , ή (+)-ισομερές, - προς τα δεξιά, μεγάλο- , ή (-)-ισομερές, - προς τα αριστερά. Ένα μείγμα ίσων ποσοτήτων εναντιομερών ονομάζεται ρακεμικό, είναι οπτικά ανενεργό και συμβολίζεται με το σύμβολο δ, λ- ή (±).
Συνοψίζοντας το μάθημα
Κατά τη διάρκεια του μαθήματος, αποκτήσατε μια γενική ιδέα για τους τύπους ισομερισμού, τι είναι ισομερές. Έμαθε για τους τύπους ισομέρειας στην οργανική χημεία: δομικό και χωρικό (στερεοϊσομέρεια). Με τη βοήθεια των δομικών τύπων των ουσιών, εξετάσαμε υποείδη δομικής ισομέρειας (σκελετική και ισομέρεια θέσης), εξοικειωθήκαμε με τις ποικιλίες χωρικής ισομέρειας: γεωμετρική και οπτική.
Βιβλιογραφία
1. Ρουτζίτης Γ.Ε. Χημεία. Βασικές αρχές Γενικής Χημείας. 10η τάξη: εγχειρίδιο για εκπαιδευτικά ιδρύματα: βασικό επίπεδο / Γ. Ε. Ρουτζίτης, Φ.Γ. Φέλντμαν. - 14η έκδοση. - Μ.: Εκπαίδευση, 2012.
2. Χημεία. Βαθμός 10. Επίπεδο προφίλ: σχολικό βιβλίο. για τη γενική εκπαίδευση ιδρύματα / V.V. Eremin, Ν.Ε. Kuzmenko, V.V. Lunin και άλλοι - Μ.: Δρόφα, 2008. - 463 σελ.
3. Χημεία. Βαθμός 11. Επίπεδο προφίλ: σχολικό βιβλίο. για τη γενική εκπαίδευση ιδρύματα / V.V. Eremin, Ν.Ε. Kuzmenko, V.V. Lunin και άλλοι - Μ.: Δρόφα, 2010. - 462 σελ.
4. Khomchenko G.P., Khomchenko I.G. Συλλογή προβλημάτων στη χημεία για όσους εισέρχονται στα πανεπιστήμια. - 4η έκδ. - M.: RIA "New Wave": Εκδότης Umerenkov, 2012. - 278 σελ.
Εργασία για το σπίτι
1. Αρ. 1,2 (σελ. 39) Ρουτζίτης Γ.Ε. Χημεία. Βασικές αρχές Γενικής Χημείας. 10η τάξη: εγχειρίδιο για εκπαιδευτικά ιδρύματα: βασικό επίπεδο / Γ. Ε. Ρουτζίτης, Φ.Γ. Φέλντμαν. - 14η έκδοση. - Μ.: Εκπαίδευση, 2012.
2. Γιατί ο αριθμός των ισομερών στους υδρογονάνθρακες της σειράς του αιθυλενίου είναι μεγαλύτερος από αυτόν των κορεσμένων υδρογονανθράκων;
3. Ποιοι υδρογονάνθρακες έχουν χωρικά ισομερή;
cis-trans-ισομέρειαή γεωμετρική ισομέρεια- ένας από τους τύπους στερεοϊσομέρειας: συνίσταται στην πιθανότητα οι υποκαταστάτες να βρίσκονται σε μία ή σε αντίθετες πλευρές του επιπέδου του διπλού δεσμού ή του μη αρωματικού δακτυλίου. Όλα τα γεωμετρικά ισομερή είναι διαστερεομερή, καθώς δεν είναι κατοπτρικές εικόνες το ένα του άλλου. cis- και έκσταση-ισομερή βρίσκονται τόσο μεταξύ οργανικών ενώσεων όσο και μεταξύ ανόργανων. Έννοιες cisκαι έκστασηδεν χρησιμοποιούνται στην περίπτωση των conformers, δύο γεωμετρίες που ρέουν εύκολα η μία μέσα στην άλλη, χρησιμοποιούνται οι χαρακτηρισμοί "syn" και "anti".
Ονομασίες « cis" και " έκσταση» προήλθε από τα λατινικά, μεταφράστηκε από αυτή τη γλώσσα cisσημαίνει «από τη μία πλευρά» και έκσταση- «στην άλλη πλευρά» ή «απέναντι». Ο όρος «γεωμετρικός ισομερισμός» σύμφωνα με την IUPAC θεωρείται ξεπερασμένος συνώνυμος cis-έκσταση-ισομέρεια.
Θα πρέπει να θυμόμαστε ότι cis-trans- περιγράφει η ονοματολογία συγγενήςδιάταξη των υποκαταστατών και δεν πρέπει να συγχέεται με Ε, Ζ- μια ονοματολογία που δίνει απόλυτοςστερεοχημική περιγραφή και ισχύει μόνο για αλκένια.
cis-transΟι αλεικυκλικές ενώσεις παρουσιάζουν επίσης -ισομέρεια, στην οποία οι υποκαταστάτες μπορούν να βρίσκονται σε μία ή σε αντίθετες πλευρές του επιπέδου του δακτυλίου. Ένα παράδειγμα είναι το 1,2-διχλωροκυκλοεξάνιο:
 |
  |
| έκσταση-1,2-διχλωροκυκλοεξάνιο | cis-1,2-διχλωροκυκλοεξάνιο |
 |
 |
| cis-2-πεντένιο | έκσταση-2-πεντένιο |
 |
 |
| cis-1,2-διχλωροαιθυλένιο | έκσταση-1,2-διχλωροαιθυλένιο |
 |
 |
| cis-βουτενοδιοϊκό οξύ (μηλεϊκό οξύ) |
έκσταση-βουτενοδιοϊκό οξύ (φουμαρικό οξύ) |
 |
 |
| Ελαϊκό οξύ | Ελαϊδικό οξύ |
Οι διαφορές μπορεί να είναι λεπτές, όπως συμβαίνει με το σημείο βρασμού αλκενίων ευθείας αλυσίδας όπως το 2-πεντένιο. cis-ισομερές του οποίου βράζει στους 37 °C και έκσταση-ισομερές - στους 36°C. Διαφορά μεταξύ cis- και έκσταση- γίνεται ακόμη μεγαλύτερος εάν υπάρχουν πολωμένοι δεσμοί στο μόριο, όπως στο 1,2-διχλωροαιθυλένιο. cis-ισομερές σε αυτή την περίπτωση βράζει στους 60,3 ° C, αλλά έκσταση-ισομερές βράζει στους 47,5 °C. Πότε cis-Το φαινόμενο ισομερούς από δύο πολικούς δεσμούς C-Cl αθροίζονται για να σχηματίσουν ένα ισχυρό μοριακό δίπολο, το οποίο προκαλεί ισχυρές διαμοριακές αλληλεπιδράσεις (δυνάμεις Keesom), οι οποίες προστίθενται στις δυνάμεις διασποράς και οδηγούν σε αύξηση του σημείου βρασμού. ΣΤΟ έκσταση-ισομερές, αντίθετα, αυτό δεν συμβαίνει, αφού οι δύο ροπές των δεσμών C–Cl βρίσκονται η μία απέναντι από την άλλη και αλληλοακυρώνονται χωρίς να δημιουργούν επιπλέον διπολική ροπή (αν και η τετραπολική ροπή τους δεν είναι καθόλου μηδενική).
Τα δύο γεωμετρικά ισομερή του βουτενοδιοϊκού οξέος είναι τόσο διαφορετικά ως προς τις ιδιότητες και την αντιδραστικότητα τους που πήραν ακόμη και διαφορετικά ονόματα: cis-ισομερές ονομάζεται μηλεϊνικό οξύ, και έκσταση-ισομερές - φουμαρικό οξύ. Η βασική ιδιότητα που καθορίζει το σχετικό σημείο βρασμού είναι η πολικότητα του μορίου, καθώς ενισχύει τις διαμοριακές αλληλεπιδράσεις, αυξάνοντας έτσι το σημείο βρασμού. Με τον ίδιο τρόπο, η συμμετρία καθορίζει το σημείο τήξης, αφού τα συμμετρικά μόρια συσσωρεύονται καλύτερα στη στερεά κατάσταση, ακόμα κι αν η πολικότητα του μορίου δεν αλλάζει. Ένα παράδειγμα τέτοιας εξάρτησης είναι το ελαϊκό και το ελαϊδικό οξύ. ελαϊκό οξύ, cis-ισομερές, έχει σημείο τήξης 13,4 °C και γίνεται υγρό σε θερμοκρασία δωματίου, ενώ έκσταση-ισομερές, ελαϊδικό οξύ, έχει υψηλότερο σημείο τήξης 43 °C επειδή είναι πιο άμεσο έκσταση-Το ισομερές έχει πιο πυκνή συσκευασία και παραμένει στερεό σε θερμοκρασία δωματίου.
cis-trans-ισομερή των δικαρβοξυλικών οξέων διαφέρουν επίσης ως προς την οξύτητα: μηλεϊνικό οξύ ( cis) είναι πολύ ισχυρότερο οξύ από το φουμαρικό ( έκσταση). Έτσι, η πρώτη σταθερά διάστασης για το φουμαρικό οξύ pK a1= 3,03 και για το μηλεϊνικό οξύ pK a1= 1,9. Αντίθετα, η σταθερά διάστασης της δεύτερης ομάδας καρβοξυλίου για το φουμαρικό οξύ είναι μεγαλύτερη από ότι για το μηλεϊνικό οξύ, δηλαδή: για το φουμαρικό οξύ pK a2= 4,44 και για το μηλεϊνικό οξύ pK a2= 6,07. Λόγω της χωρικής εγγύτητας των καρβοξυλομάδων στο cis- μορφή, η τάση του υδρογόνου να ιονίζεται αυξάνεται, άρα η πρώτη σταθερά του μηλεϊνικού οξέος είναι μεγαλύτερη. Ωστόσο, είναι πιο δύσκολο για το δεύτερο πρωτόνιο να ξεπεράσει την έλξη δύο στενών καρβοξυλικών ομάδων cis-ισομερές, άρα η δεύτερη σταθερά διάστασης του μηλεϊνικού οξέος είναι μικρότερη από αυτή του φουμαρικού οξέος. Μια παρόμοια αρχή ισχύει για τα αλεικυκλικά δικαρβοξυλικά οξέα, ωστόσο, καθώς αυξάνεται το μέγεθος του δακτυλίου, θα πρέπει επίσης να λαμβάνεται υπόψη η επίδραση του μη επίπεδου σχήματος δακτυλίου.
Η γειτονική σταθερά σύζευξης πυρηνικής σπιν-σπιν (3 J HH) μετρήθηκε με φασματοσκοπία NMR, περισσότερα για έκσταση-ισομερή (εύρος: 12-18 Hz, μέσος όρος: 15 Hz) από ότι για cis-ισομερή (εύρος: 0-12 Hz, μέσος όρος: 8 Hz).
Κατά κανόνα για άκυκλα συστήματα έκσταση cis. Ο λόγος για αυτό είναι συνήθως η ενίσχυση των ανεπιθύμητων στερεοχημικών αλληλεπιδράσεων των στενά απεχόντων υποκαταστατών σε cis-ισομέρεια. Για τον ίδιο λόγο, η ειδική θερμότητα της καύσης έκσταση-ισομερή χαμηλότερα από cis, που υποδηλώνει μεγαλύτερη θερμοδυναμική σταθερότητα. Εξαιρέσεις σε αυτόν τον κανόνα είναι το 1,2-διφθοροαιθυλένιο, το 1,2-διφθοροδιαζένιο (FN=NF), το 1-βρωμοπροπένιο-1 και πολλά άλλα υποκατεστημένα με αλογόνο και οξυγόνο αιθυλένια. Σε αυτήν την περίπτωση cis-το ισομερές είναι πιο σταθερό από έκσταση-ισομερές, αφού μεταξύ τέτοιων υποκαταστατών δεν επικρατούν απωθητικές δυνάμεις, αλλά ελκτικές δυνάμεις (όπως οι δυνάμεις του Λονδίνου). Επιπλέον, λόγω του σχετικά μικρού όγκου των υποκαταστατών, δεν προκύπτει στερεοχημική παρεμπόδιση. Από τα 1,2-διαλογονοαιθυλένια, μόνο το 1,2-διιωδοαιθυλένιο έχει πιο σταθερό trans ισομερές από cis-ισομερές, γιατί λόγω της μεγάλης ακτίνας, τα άτομα ιωδίου παρουσιάζουν ισχυρή χωρική αλληλεπίδραση εάν βρίσκονται στην ίδια πλευρά του διπλού δεσμού.
Τα γεωμετρικά ισομερή, η διαφορά των οποίων σχετίζεται με τη θέση των υποκαταστατών γύρω από τον διπλό δεσμό, διαφέρουν από στερεοϊσομερείς μορφές διαφορετικού τύπου - διαμορφωτές. Ξεχωριστή ύπαρξη cis- και έκσταση-ισομερή, στην ουσία, είναι δυνατά μόνο λόγω του υψηλού ενεργειακού φραγμού της περιστροφής γύρω από τον διπλό δεσμό, που καθιστά δυνατό τον διαχωρισμό της ύπαρξης cis- και έκσταση-ισομερή, ενώ τα conformers υπάρχουν μόνο με τη μορφή μείγματος ισορροπίας. Η τιμή του φραγμού περιστροφής γύρω από τον διπλό δεσμό στα απλά αλκένια είναι 250-270 kJ/mol. Ωστόσο, εάν τοποθετηθούν ισχυροί δότες ηλεκτρονίων (-SR) στη μία πλευρά και ομάδες, ισχυροί δέκτες ηλεκτρονίων (-CN, -COC 6 H 5) τοποθετηθούν στην άλλη, πολώντας έτσι τον διπλό δεσμό, αυτό θα οδηγήσει σε σημαντική μείωση του φραγμού περιστροφής. Το εμπόδιο στην περιστροφή γύρω από έναν δεσμό που πολώνεται έτσι μπορεί να μειωθεί στα 60-100 kJ/mol. Χαμηλά ενεργειακά εμπόδια όταν η διαφορά ενέργειας μεταξύ cis-trans-ισομερή και μορφομερή εξομαλύνονται, βρίσκονται για παράγωγα αμίνης ακετοξικού εστέρα και εναμινοκετόνες. Αποδεικνύεται ότι η θέση ισορροπίας σε τέτοια συστήματα εξαρτάται από τη φύση του διαλύτη. Έτσι, οι εναμινοκετόνες σε μη πολικούς διαλύτες υπάρχουν 100% σε cis-Μορφή σταθεροποιημένη με εσωτερικό δεσμό υδρογόνου και σε πολικούς διαλύτες έως και 50% έκσταση- έντυπα.
σύστημα σημειογραφίας cis-έκστασηείναι καλά εφαρμόσιμο μόνο για την ονομασία ισομερών αλκενίων με δύο διαφορετικούς τύπους υποκαταστατών στον διπλό δεσμό, σε πολύπλοκα μόρια μια τέτοια ονοματολογία γίνεται πολύ ασαφής. Σε αυτές τις περιπτώσεις, η ανεπτυγμένη IUPAC μι,Ζ- μια σημείωση που ορίζει μοναδικά το όνομα των ενώσεων για όλες τις πιθανές περιπτώσεις, και επομένως είναι ιδιαίτερα χρήσιμο για την ονομασία τρι- και τετρα-υποκατεστημένα αλκενίων. Αυτό το σύστημα αποφεύγει τη σύγχυση σχετικά με το ποιες ομάδες πρέπει να ληφθούν υπόψη. cis- ή έκσταση- σε σχέση μεταξύ τους.
Αν οι δύο παλαιότερες ομάδες βρίσκονται στην ίδια πλευρά του διπλού δεσμού, δηλαδή είναι μέσα cis- θέση μεταξύ τους, τότε μια τέτοια ουσία ονομάζεται Ζ-ισομερές (από τα γερμανικά zusammen - μαζί). Όταν οι παλαιότερες ομάδες βρίσκονται σε αντίθετες πλευρές του διπλού δεσμού (σε έκσταση-προσανατολισμός), τότε ονομάζεται ένα τέτοιο ισομερές μι-ισομερές (από τα γερμανικά entgegen - αντίθετο). Η σειρά προτεραιότητας των ομάδων και των ατόμων καθορίζεται από τους κανόνες του Kahn - Ingold - Prelog. Για καθένα από τα δύο άτομα του διπλού δεσμού, είναι απαραίτητο να προσδιοριστεί η αρχαιότητα κάθε υποκαταστάτη. Εάν και οι δύο ανώτεροι υποκαταστάτες βρίσκονται στην ίδια πλευρά του επιπέδου π-δεσμού, τότε αυτή η διαμόρφωση συμβολίζεται με το σύμβολο Ζ, εάν αυτές οι ομάδες βρίσκονται σε αντίθετες πλευρές του επιπέδου π-δεσμού, τότε η διαμόρφωση συμβολίζεται με το σύμβολο μι .
πρέπει να σημειωθεί ότι cis/έκστασηκαι μι,Ζ-οι ονοματολογίες βασίζονται στη σύγκριση διαφορετικών υποκαταστατών αλκενίων, επομένως Ζ-Το ισομερές δεν ταιριάζει πάντα cis-ισομερές, και μι-ισομερές - έκσταση-ισομέρεια. Για παράδειγμα, έκσταση-2-χλωροβουτένιο-2 (δύο ομάδες μεθυλίου C1 και C4, στην κύρια αλυσίδα του βουτενίου-2α βρίσκονται σε έκσταση-προσανατολισμός) είναι ( Ζ)-2-χλωροβουτένιο-2 (το χλώριο είναι παλαιότερο από το μεθύλιο, το οποίο με τη σειρά του είναι παλαιότερο από το υδρογόνο, επομένως το χλώριο και το C4-μεθύλιο θεωρούνται μαζί).
cis–έκσταση-ισομερισμός απαντάται επίσης σε ανόργανες ενώσεις, κυρίως σε διαζένια και σύνθετες ενώσεις.
Τα διαζένια (και τα σχετικά διφωσφαίνια) παρουσιάζουν cis-trans-ισομερισμός. Όπως και στην περίπτωση των οργανικών ενώσεων, cis-Το ισομερές είναι πιο αντιδραστικό, μόνο που μπορεί να ανάγει τα αλκένια και τα αλκίνια σε αλκάνια. Εκσταση- το ισομερές, που πλησιάζει το αλκένιο, δεν μπορεί να ευθυγραμμίσει τα άτομα υδρογόνου του για να μειώσει αποτελεσματικά το αλκένιο, και cis-ισομερές λόγω της κατάλληλης μορφής αντιμετωπίζει με επιτυχία αυτό το έργο.
  |
  |
| έκσταση- διαζενίου | cis- διαζενίου |
Οι ανόργανες ενώσεις συντονισμού με οκταεδρική ή επίπεδη τετράγωνη γεωμετρία υποδιαιρούνται επίσης σε cis-ισομερή στα οποία βρίσκονται οι ίδιοι συνδέτες δίπλα δίπλα, και έκσταση-ισομερή στα οποία οι συνδέτες διαχωρίζονται μεταξύ τους.
Για παράδειγμα, υπάρχουν δύο τετράγωνα επίπεδα γεωμετρικά ισομερή για το Pt(NH 3) 2 Cl 2 , ένα φαινόμενο που εξήγησε ο Alfred Werner το 1893. cis-ισομερές με πλήρες όνομα cis-Η διχλωροδιαμμινοπλατίνα (II) έχει αντικαρκινική δράση, η οποία αποδείχθηκε από τον Barnett Rosenberg το 1969. Τώρα αυτή η ουσία είναι γνωστή στη χημειοθεραπεία με τη σύντομη ονομασία σισπλατίνη. Εκσταση-ισομερές (transplatin), αντίθετα, δεν έχει καμία φαρμακευτική δράση. Κάθε ένα από αυτά τα ισομερή μπορεί να συντεθεί με βάση το αποτέλεσμα trans, το οποίο καθιστά δυνατή την απόκτηση κυρίως του επιθυμητού ισομερούς.
 |
 |
|
cis- + και έκσταση- + |
||
Για οκταεδρικά σύμπλοκα με τον τύπο MX 4 Y 2, υπάρχουν επίσης δύο ισομερή. (Εδώ το Μ είναι άτομο μετάλλου και το Χ και το Υ είναι διαφορετικά είδη συνδέτη.) cis-ισομερές, δύο συνδέτες Υ είναι γειτονικά ο ένας στον άλλο υπό γωνία 90°, όπως φαίνεται για τα άτομα χλωρίου σε cis- + στην αριστερή εικόνα. ΣΤΟ έκσταση-ισομερές που φαίνεται στα δεξιά, δύο άτομα χλωρίου βρίσκονται στα αντίθετα άκρα της διαγωνίου που διέρχεται από το κεντρικό άτομο κοβαλτίου.
Ένας παρόμοιος τύπος ισομέρειας των οκταεδρικών συμπλεγμάτων MX 3 Y 3 είναι grand os-ισομερισμός, ή αξονική ισομέρεια προσώπου, όταν υπάρχει ένας ορισμένος αριθμός προσδεμάτων cis- ή έκσταση- θέση μεταξύ τους. ΣΤΟ gran-ισομερή, συνδέτες του ίδιου τύπου καταλαμβάνουν τις κορυφές της τριγωνικής όψης του οκταέδρου και σε os-ισομερή, οι ίδιοι συνδέτες βρίσκονται σε τρεις γειτονικές θέσεις έτσι ώστε δύο συνδέτες να βρίσκονται σε αντίθετες πλευρές του κεντρικού ατόμου και στον ίδιο άξονα με αυτό
Τα γεωμετρικά ισομερή προκύπτουν όταν η ελεύθερη περιστροφή των ατόμων σε ένα μόριο είναι περιορισμένη λόγω της παρουσίας διπλού δεσμού. Το μηλεϊνικό (12.23) και το φουμαρικό (12.24) οξέα (cis- και trans-αντίστοιχα) μπορούν να χρησιμεύσουν ως παράδειγμα ενός τέτοιου ζεύγους ισομερών.
Τα γεωμετρικά ισομερή είναι πολύ παρόμοια σε χημική δομή, αλλά δεν είναι κατοπτρικά είδωλα το ένα του άλλου και δεν περιστρέφουν το επίπεδο πόλωσης του φωτός. Κατά κανόνα, τα ισομερή cis και trans διαφέρουν σημαντικά στις φυσικές ιδιότητες. Για παράδειγμα, το μηλεϊνικό οξύ (12.23) τήκεται στους 130°C, η τιμή του pKa είναι 1.9, είναι πολύ διαλυτό σε κρύο νερό (79 g ανά 100 ml). οι σταθερές του γεωμετρικού του ισομερούς - φουμαρικό οξύ (12,24) είναι αντίστοιχα 287 ° C, 3,0 και 0,7 g ανά 100 ml. Δεν αποτελεί έκπληξη το γεγονός ότι τα γεωμετρικά ισομερή έχουν διαφορετικές βιολογικές ιδιότητες, και επομένως είναι πολύ σημαντικό κατά τη μελέτη του χημικού τύπου μιας νέας ένωσης να ληφθούν υπόψη όλες οι πιθανότητες για την ύπαρξη αυτού του τύπου ισομερισμού.
Τα ισομερή cis και trans μπορούν εύκολα να διαχωριστούν με κρυστάλλωση ή χρωματογραφία. Δεν υπάρχει γενική μέθοδος για τη μετατροπή ενός ισομερούς σε άλλο, αλλά η θέρμανση παράγει γενικά το πιο σταθερό ισομερές και η έκθεση στο φως παράγει το λιγότερο σταθερό ισομερές. Η ανθρώπινη όραση εξαρτάται από τη μετατροπή του 11-cis ισομερούς του αμφιβληστροειδούς στη μορφή 11-trans υπό τη δράση του φωτός. Μόλις η συναρπαστική δέσμη φωτός εξαφανιστεί,
Αυτή η καροτενοειδής χρωστική ουσία περνά και πάλι στη μορφή cis, διακόπτοντας έτσι την ώθηση που πηγαίνει στον εγκέφαλο.Cis- και trans-ισομερή υπάρχουν επίσης στον επίπεδο δακτύλιο κυκλοπεντανίου, που είναι, σαν να ήταν, ένας μεγάλος διπλός δεσμός. Αν και ο δακτύλιος του κυκλοεξανίου δεν είναι καθόλου επίπεδος, είναι ωστόσο αρκετά επίπεδος για να σχηματίσει cis και trans ισομερή. Έτσι, υπάρχουν και είναι διαθέσιμες και οι δύο μορφές cis- (12.25) και trans- (12.26) διαμινοκυκλοεξανίου. Το ίδιο μόριο μπορεί να σχηματίσει γεωμετρικά και οπτικά ισομερή. Για παράδειγμα, το trans ισομερές (12.26) μπορεί να διαχωριστεί στα χειραλικά ισομερή (S,S) (12.27) και (R.R) (12.28). Ωστόσο, το cis-ισομερές δεν μπορεί να διαιρεθεί σε χειρόμορφες μορφές, αφού έχει ένα επίπεδο συμμετρίας. Ο δακτύλιος βενζολίου δεν έχει γεωμετρικά ισομερή, αφού κάθε άτομο άνθρακα του δακτυλίου έχει μόνο έναν υποκαταστάτη.
Cis-Trans- TpaHC-(S S) TpaHC-(R.R) (12.25) (12.26) (12.27) (12.28) |
Στερεοϊσομερή του 1,2-διαμινοκινλογενσανίου
Μερικές φορές είναι δύσκολο να επιλεγούν δύο από τους τέσσερις υποκαταστάτες σε έναν διπλό δεσμό για να προσδιοριστεί η διαμόρφωση cis ή trans. Ο κανόνας της ακολουθίας ορίζει την επιλογή των υποκαταστατών με τα βαρύτερα άτομα, ενώ η μορφή cis συμβολίζεται με το γράμμα Z (από τη γερμανική λέξη zusammen) και ο μετασχηματισμός με το γράμμα E (entgegen). Μερικές φορές στα ονόματα των ενώσεων στις οποίες η γεωμετρική ισομέρεια μπορεί να εκδηλωθεί επανειλημμένα, ο υποκαταστάτης που έχει τον μικρότερο αριθμό (σύμφωνα με τον κανόνα αρίθμησης) συμβολίζεται με το γράμμα r και οι ονομασίες c-(cis) και t-(trans) στο μπροστά από άλλους αναπληρωτές δείχνουν τη θέση τους σε σχέση με τον κ. Αναπληρωτή.
Παρόμοια με το ινδολο-3-υλοξικό οξύ (4.82), το οποίο διεγείρει την ανάπτυξη των φυτικών κυττάρων, μπορούν επίσης να δράσουν και άλλα καρβοξυλικά οξέα, η καρβοξυλική ομάδα των οποίων βρίσκεται υπό γωνία ως προς το επίπεδο του αρωματικού δακτυλίου. Ο γεωμετρικός ισομερισμός περιορίζει την πιθανότητα μιας τέτοιας διάταξης δύο υποκαταστατών, επομένως, από τα κινναμωμικά οξέα, μόνο το ισομερές cis είναι ενεργό. Στα 2-φαινυλοκυκλοπροπανο-1-καρβοξυλικά και 1,2,3,4-τετραϋδροναφθαλιδενο-Οξεικά οξέα, μόνο cis-ισομερή είναι επίσης ενεργά. Τα μοριακά μοντέλα δείχνουν ότι ο δακτύλιος και η καρβοξυλομάδα στο trans-ισομερές (ανενεργό) αυτών των ουσιών βρίσκονται στο ίδιο επίπεδο, ενώ στη μορφή cis (ενεργό) δεν είναι ομοεπίπεδα. Ήταν ο πρώτος που επεσήμανε αυτή τη σχέση μεταξύ της μη ομοεπίπεδης και της δραστηριότητας τόνωσης της ανάπτυξης του Veidstra. Η μη ομοεπίπεδη κατάσταση μπορεί επίσης να προκύψει λόγω στερικών εμποδίων. Έτσι, το βενζοϊκό οξύ έχει επίπεδο σχήμα και δεν είναι ενεργό, ενώ το 2,6-διχλωροβενζοϊκό και το 8-μεθυλ-1-ναφθοϊκό οξύ είναι μη επίπεδα και βιολογικά ενεργά.
Σε ανάλογα αυξινών, η καρβοξυλική ομάδα μπορεί επίσης να αντικατασταθεί από άλλες ομάδες που αποσπούν ηλεκτρόνια (-CN, -N02, -SO3H), ενώ η βιολογική δραστηριότητα μειώνεται ελαφρώς. Για τη σύνδεση μεταξύ δομής και δράσης σε αυτή τη σειρά, βλέπε Koepfli, Thimann, Went (1938) και Veidstra
Η γεωμετρική ισομέρεια των στεροειδών αξίζει ιδιαίτερης προσοχής. Ο τύπος (12.29) δείχνει τη γενική δομή αυτής της ομάδας φυσικών κορεσμένων ενώσεων (εμφανίζεται η αρίθμηση των ατόμων άνθρακα και οι ονομασίες γραμμάτων των τεσσάρων κύκλων). Στα φυσικά στεροειδή, οι δακτύλιοι Β και C βρίσκονται σε διασταύρωση, και οι δύο είναι αγκυρωμένοι σε μια διαμόρφωση καρέκλας. Στους καρδιακούς γλυκοσίδες, η ένωση των κύκλων C και D έχει μια διαμόρφωση cis, αλλά στις ζωικές ορμόνες, τις στερόλες και τα χολικά οξέα, έχει μια διασταύρωση. Στα περισσότερα βιολογικά ενεργά στεροειδή, οι δακτύλιοι Α και Β βρίσκονται σε διασταύρωση (σειρά «5a», παλαιότερα ονομαζόταν «allo»). Καθένας από τους δακτυλίους στο μόριο του στεροειδούς σχηματίζει πτυχώσεις, κάτι που φαίνεται καθαρά στην πλευρική προβολή του τύπου (12.30).
Ο χαρακτηρισμός "5a" υποδεικνύει ότι το άτομο υδρογόνου στη θέση 5 βρίσκεται κάτω από το κοινό επίπεδο των δακτυλίων. Όλοι οι υποκαταστάτες που βρίσκονται κάτω από αυτό το επίπεδο υποδηλώνονται με το σύμβολο "a" και πάνω - με το σύμβολο που φαίνεται στους τύπους (12.34) και (12.35).
Το σχήμα της καρέκλας είναι το λιγότερο καταπονημένο και, επομένως, περισσότερο προτιμότερο για το μόριο κυκλοεξανίου, με κάθε αξονικό άτομο υδρογόνου να αφαιρείται κατά 0,25 nm από τα άλλα δύο αξονικά άτομα υδρογόνου που βρίσκονται στην ίδια πλευρά του κύκλου. Το στριφτό (ή στριφογυριστό) σχήμα καταλαμβάνει μια ενδιάμεση θέση (μεταξύ των σχημάτων καρέκλας και βάρκας) και το πιο αγχωτικό είναι το σχήμα της μπανιέρας. Το τελευταίο, ωστόσο, μπορεί να σταθεροποιηθεί με δύο ή περισσότερους συντηγμένους δακτυλίους που περιέχουν κατάλληλους υποκαταστάτες. Το μόριο δεκαϋδροναφθαλίνης (δεκαλίνη) μπορεί να υπάρχει με τη μορφή δύο σταθερών μορφών, η δομή των οποίων προσδιορίστηκε με περίθλαση ηλεκτρονίων, η οποία έδειξε ότι η trans μορφή (σημείο τήξης -30 ° C, σημείο βρασμού 117 ° C στα 100 mm Hg) αποτελείται από δύο συντηγμένους δακτυλίους στη διαμόρφωση της καρέκλας και η μορφή cis (σημείο τήξης -43 °C, σημείο βρασμού 124 °C στα 100 mm Hg) αποτελείται από δύο συντηγμένους δακτυλίους cis στη διαμόρφωση της καρέκλας. Η μορφή cis μετατρέπεται στη μορφή trans σε υψηλή θερμοκρασία και παρουσία καταλύτη. Το μόριο δεκαλίνης είναι ένα παράδειγμα γεωμετρικού ισομερισμού σε σχέση με τους άνθρακες γεφύρωσης, αλλά κάθε κύκλος παραμένει διαμορφωτικά κινητός.
Ενδιαφέρον παρουσιάζει η διαμορφωτική ανάλυση του δεσμού -CO-H-, που καθορίζει τη δομή των πεπτιδίων. Στις πρωτεΐνες, η διαμόρφωσή του είναι πάντα «εκτεταμένη» (trans), αν και σε πεπτίδια που περιέχουν προλίνη, δηλαδή μια τριτοταγή αμιδική ομάδα, η αναλογία της «σκοτεινής» (cis) διαμόρφωσης ισορροπίας είναι αρκετά μεγάλη (έως 40%). Στα δευτερογενή φορμαμίδια, υπάρχει ένα μείγμα ισορροπίας «εκτεταμένων» και «σκοτεινών» διαμορφωτών σε αναλογία 8:92 στην περίπτωση του Ν-μεθυλοφορμαμιδίου (12,39, 12,40). Η ύπαρξή τους διαπιστώθηκε από την παρουσία δύο ξεχωριστών σημάτων στα φάσματα PMR. Με την αύξηση του όγκου του υποκαταστάτη στο άτομο αζώτου, η αναλογία του «εκτεταμένου» διαμορφωτή αυξάνεται, φτάνοντας το 18% όταν η μεθυλική ομάδα αντικαθίσταται από τριτ-βουτύλιο.