

 I. ایزومریسم (از یونانی isos - برابر) Berzelius، 1830. ایزومرها موادی هستند که فرمول مولکولی یکسانی دارند (ترکیب کمی و کیفی یکسان)، اما در ترتیب اتصال اتم ها و (یا) آرایش آنها در فضا و خواص متفاوتی دارند.
I. ایزومریسم (از یونانی isos - برابر) Berzelius، 1830. ایزومرها موادی هستند که فرمول مولکولی یکسانی دارند (ترکیب کمی و کیفی یکسان)، اما در ترتیب اتصال اتم ها و (یا) آرایش آنها در فضا و خواص متفاوتی دارند.
 Berzelius, Jöns Jacob 1779 - 1848 شیمیدان مشهور سوئدی. از سال 1807 استاد پزشکی و داروسازی در استکهلم.
Berzelius, Jöns Jacob 1779 - 1848 شیمیدان مشهور سوئدی. از سال 1807 استاد پزشکی و داروسازی در استکهلم.
 C 2 H 6 O دی متیل اتر Tbp = -24 C اتیل الکل Tbp = 78 C n-بوتان Tbp = -0.5 C C 4 H 10 ایزوبوتان Tbp = -11.7 C
C 2 H 6 O دی متیل اتر Tbp = -24 C اتیل الکل Tbp = 78 C n-بوتان Tbp = -0.5 C C 4 H 10 ایزوبوتان Tbp = -11.7 C
 تعداد ایزومرهای سری آلکان 10 بوتان 2 C 14 H 30 تترادکان 1 858 C 5 H 12 پنتان 3 C 15 H 32 پنتادکان 4 347 C 6 H 14 هگزان 5 C 20 H 42 ایکوزان C 25 H 7 H 52 پنتاکوزان 36 797 588 C 8 H 18 اکتان 18 C 30 H 62 تریاکونتان 4 111 846 763 C 9 H 20 نونان 35 C 40 H 82 تتراکونتان 62 491 170 173
تعداد ایزومرهای سری آلکان 10 بوتان 2 C 14 H 30 تترادکان 1 858 C 5 H 12 پنتان 3 C 15 H 32 پنتادکان 4 347 C 6 H 14 هگزان 5 C 20 H 42 ایکوزان C 25 H 7 H 52 پنتاکوزان 36 797 588 C 8 H 18 اکتان 18 C 30 H 62 تریاکونتان 4 111 846 763 C 9 H 20 نونان 35 C 40 H 82 تتراکونتان 62 491 170 173
 II. همسانی گروههای ترکیبات آلی از یک نوع ساختار با گروههای عاملی یکسان، که از نظر تعداد گروههای -CH 2 - در زنجیره کربن با یکدیگر متفاوت هستند، یک سری همولوگ را تشکیل میدهند. سری همولوگ متان
II. همسانی گروههای ترکیبات آلی از یک نوع ساختار با گروههای عاملی یکسان، که از نظر تعداد گروههای -CH 2 - در زنجیره کربن با یکدیگر متفاوت هستند، یک سری همولوگ را تشکیل میدهند. سری همولوگ متان
 III. سریال ایزولوژیک. l l اینها مجموعه ای از مواد هستند که از همان تعداد اتم کربن ساخته شده اند، اما در ترکیب کمی اتم های H متفاوت هستند، یعنی هر عضو بعدی سری حاوی 2 اتم H کمتر از قبلی است: C 2 H 6 اتان C 2 H 4 اتیلن C 2 H 2 استیلن
III. سریال ایزولوژیک. l l اینها مجموعه ای از مواد هستند که از همان تعداد اتم کربن ساخته شده اند، اما در ترکیب کمی اتم های H متفاوت هستند، یعنی هر عضو بعدی سری حاوی 2 اتم H کمتر از قبلی است: C 2 H 6 اتان C 2 H 4 اتیلن C 2 H 2 استیلن






 ایزومر ساختاری 3. توتومریسم (ایزومر اولیه یا پویا) توتومریسم (از یونانی ταύτίς - همان و μέρος - اندازه گیری) پدیده همزیستی دو شکل ایزومر است که در تعادل متحرک هستند و قادرند خود به خود به یکدیگر تبدیل شوند.
ایزومر ساختاری 3. توتومریسم (ایزومر اولیه یا پویا) توتومریسم (از یونانی ταύτίς - همان و μέρος - اندازه گیری) پدیده همزیستی دو شکل ایزومر است که در تعادل متحرک هستند و قادرند خود به خود به یکدیگر تبدیل شوند.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="(!LANG:Conformation >С ------- С Conformation >С ------- С
 ایزومر هندسی ایزومرهای هندسی - دارای ترتیب (توالی) پیوندهای یکسانی در مولکول هستند، اما در آرایش اتم ها (گروه ها) در فضا نسبت به صفحه پیوند دوگانه یا چرخه کوچک متفاوت هستند.
ایزومر هندسی ایزومرهای هندسی - دارای ترتیب (توالی) پیوندهای یکسانی در مولکول هستند، اما در آرایش اتم ها (گروه ها) در فضا نسبت به صفحه پیوند دوگانه یا چرخه کوچک متفاوت هستند.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="(!LANG: Butene-2 cis و ایزومرهای ترانس هر اتم دارای >C=C سیس و ایزومرهای ترانس butene- است. 2 هر اتم > C=C
 "در این طرف و آن طرف" رودخانه لیتا سیسلیتانیا - نام سرزمین های تاج اتریش؛ با رنگ قرمز نشان داده شده است؛ 1867 -1918 Transleitania - نام سرزمین های تاج مجارستان. به رنگ سبز نشان داده شده است
"در این طرف و آن طرف" رودخانه لیتا سیسلیتانیا - نام سرزمین های تاج اتریش؛ با رنگ قرمز نشان داده شده است؛ 1867 -1918 Transleitania - نام سرزمین های تاج مجارستان. به رنگ سبز نشان داده شده است




 E, Z-nomenclature 2 1 E-1 -nitro-1 -bromo-2 -chloropentene 1 2 Z-1 -nitro-1 -bromo-2 -chloropentene 1. با استفاده از قوانین Kahn-Ingold-Prelog، ارشدیت نسبی را تعیین کنید. از جایگزین ها، توسط یک پیوند دوگانه به هم متصل می شوند و به آنها یک شماره اولویت 1 یا 2 می دهیم.
E, Z-nomenclature 2 1 E-1 -nitro-1 -bromo-2 -chloropentene 1 2 Z-1 -nitro-1 -bromo-2 -chloropentene 1. با استفاده از قوانین Kahn-Ingold-Prelog، ارشدیت نسبی را تعیین کنید. از جایگزین ها، توسط یک پیوند دوگانه به هم متصل می شوند و به آنها یک شماره اولویت 1 یا 2 می دهیم.
 الف) اتمی با عدد اتمی بالاتر بر اتمی با عدد اتمی کمتر برتری دارد. ب) اگر دو اتم ایزوتوپ باشند، اتمی با عدد جرمی بزرگتر دارای مزیت است. 2. اگر دو گروه ارشد در یک سمت صفحه پیوند π قرار داشته باشند، پیکربندی جایگزین با نماد Z نشان داده می شود (از zusammen آلمانی با هم) اگر این گروه ها در طرف مقابل از π- باشند. صفحه پیوند، سپس پیکربندی با نماد E نشان داده می شود (از آلمانی entgegen مقابل)
الف) اتمی با عدد اتمی بالاتر بر اتمی با عدد اتمی کمتر برتری دارد. ب) اگر دو اتم ایزوتوپ باشند، اتمی با عدد جرمی بزرگتر دارای مزیت است. 2. اگر دو گروه ارشد در یک سمت صفحه پیوند π قرار داشته باشند، پیکربندی جایگزین با نماد Z نشان داده می شود (از zusammen آلمانی با هم) اگر این گروه ها در طرف مقابل از π- باشند. صفحه پیوند، سپس پیکربندی با نماد E نشان داده می شود (از آلمانی entgegen مقابل)



 لویی پاستور (27. 12. 1822 -28. 09. 1895) شیمیدان فرانسوی، بزرگترین محقق قرن 19 "عدم تقارن چیزی است که جهان آلی را از غیر آلی متمایز می کند" (این قانون پایه و اساس استریوشیمی را ایجاد کرد). بلورهای نامتقارن دارای خاصیت چرخش نور قطبی شده هستند.
لویی پاستور (27. 12. 1822 -28. 09. 1895) شیمیدان فرانسوی، بزرگترین محقق قرن 19 "عدم تقارن چیزی است که جهان آلی را از غیر آلی متمایز می کند" (این قانون پایه و اساس استریوشیمی را ایجاد کرد). بلورهای نامتقارن دارای خاصیت چرخش نور قطبی شده هستند.
 انانتیومرها ایزومرهای فضایی هستند که مولکولهای آنها به عنوان یک جسم و یک تصویر آینه ای ناسازگار با یکدیگر ارتباط دارند. (از یونانی enantios - مقابل).
انانتیومرها ایزومرهای فضایی هستند که مولکولهای آنها به عنوان یک جسم و یک تصویر آینه ای ناسازگار با یکدیگر ارتباط دارند. (از یونانی enantios - مقابل).
 کایرالیته (به انگلیسی chirality، از یونانی chéir - hand)، مفهومی در شیمی که مشخص میکند ویژگی یک جسم با انعکاس آن در یک آینه مسطح ایدهآل ناسازگار است.
کایرالیته (به انگلیسی chirality، از یونانی chéir - hand)، مفهومی در شیمی که مشخص میکند ویژگی یک جسم با انعکاس آن در یک آینه مسطح ایدهآل ناسازگار است.






 فیشر امیل هرمان (۹ اکتبر ۱۸۵۲، ایسکیرخن - ۱۵ ژوئیه ۱۹۱۹، برلین)، شیمیدان آلی و بیوشیمیدان آلمانی.
فیشر امیل هرمان (۹ اکتبر ۱۸۵۲، ایسکیرخن - ۱۵ ژوئیه ۱۹۱۹، برلین)، شیمیدان آلی و بیوشیمیدان آلمانی.


 پیش بینی های فیشر را می توان تبدیل کرد: l l 1. تعداد زوج جایگشت های جایگزین فرمول را تغییر نمی دهد. 2. تعداد فرد از جایگشت های جایگزین منجر به فرمول آنتی پاد (انانتیومر) می شود. 3. چرخاندن فرمول 90 یا 270 و همچنین استنتاج فرمول از این صفحه ممنوع است (این اقدامات منجر به فرمول آنتی پاد می شود). 4. مجاز است کل فرمول را در صفحه نقاشی 180 بچرخانید.
پیش بینی های فیشر را می توان تبدیل کرد: l l 1. تعداد زوج جایگشت های جایگزین فرمول را تغییر نمی دهد. 2. تعداد فرد از جایگشت های جایگزین منجر به فرمول آنتی پاد (انانتیومر) می شود. 3. چرخاندن فرمول 90 یا 270 و همچنین استنتاج فرمول از این صفحه ممنوع است (این اقدامات منجر به فرمول آنتی پاد می شود). 4. مجاز است کل فرمول را در صفحه نقاشی 180 بچرخانید.
 پیکربندی نسبی 1906، به پیشنهاد M. A. Rozanov L- و D-ایزومرها (از کلمات لاتین laevus - چپ و dexter - راست).
پیکربندی نسبی 1906، به پیشنهاد M. A. Rozanov L- و D-ایزومرها (از کلمات لاتین laevus - چپ و dexter - راست).



 سیستم کان-اینگولد-پریلوگ؟ Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (بریتانیا) (سوئیس)
سیستم کان-اینگولد-پریلوگ؟ Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (بریتانیا) (سوئیس)



 تعداد کل ایزومرهای نوری با فرمول N = 2 n تعیین می شود، n تعداد مراکز کایرالیته است. I III IV 2-آمینو-3-هیدروکسی بوتانوئیک اسید
تعداد کل ایزومرهای نوری با فرمول N = 2 n تعیین می شود، n تعداد مراکز کایرالیته است. I III IV 2-آمینو-3-هیدروکسی بوتانوئیک اسید
 تارتاریک اسید I III IV erythro threo Epimers دیاسترئومرهایی هستند که در پیکربندی تنها یک مرکز نامتقارن متفاوت هستند.
تارتاریک اسید I III IV erythro threo Epimers دیاسترئومرهایی هستند که در پیکربندی تنها یک مرکز نامتقارن متفاوت هستند.

 Racemate (از لاتین racemus - انگور). هنگام اختلاط مقادیر هممولاری استریوایزومرهای D - و L - مخلوطهای غیرفعال نوری تشکیل میشوند که S راسمیک (از lat. sinister - چپ) و R (lat. rectus - سمت راست) نامیده میشوند. راسمت با نماد RS نشان داده می شود. شکافتن مخلوط های راسمیک: 1. روش مکانیکی (روش پاستور). 2. روش میکروبیولوژیکی 3. روش آنزیمی. 4. روش شیمیایی. کروماتوگرافی میل ترکیبی
Racemate (از لاتین racemus - انگور). هنگام اختلاط مقادیر هممولاری استریوایزومرهای D - و L - مخلوطهای غیرفعال نوری تشکیل میشوند که S راسمیک (از lat. sinister - چپ) و R (lat. rectus - سمت راست) نامیده میشوند. راسمت با نماد RS نشان داده می شود. شکافتن مخلوط های راسمیک: 1. روش مکانیکی (روش پاستور). 2. روش میکروبیولوژیکی 3. روش آنزیمی. 4. روش شیمیایی. کروماتوگرافی میل ترکیبی
 رابطه متقابل ساختار استریوشیمیایی با تجلی فعالیت بیولوژیکی. آدرنالین، اپی نفرین IUPAC: 1 - (3، 4 -دی هیدروکسی فنیل) -2 متیل آمینو اتانول - هورمون مدولای آدرنال حیوانات و انسان. واسطه سیستم عصبی حیوانات خونسرد. از بین دو انانتیومر آدرنالین، آدرنالین R (-) بالاترین فعالیت دارویی را نشان می دهد.
رابطه متقابل ساختار استریوشیمیایی با تجلی فعالیت بیولوژیکی. آدرنالین، اپی نفرین IUPAC: 1 - (3، 4 -دی هیدروکسی فنیل) -2 متیل آمینو اتانول - هورمون مدولای آدرنال حیوانات و انسان. واسطه سیستم عصبی حیوانات خونسرد. از بین دو انانتیومر آدرنالین، آدرنالین R (-) بالاترین فعالیت دارویی را نشان می دهد.

 رابطه متقابل ساختار استریوشیمیایی با تجلی فعالیت بیولوژیکی. ایزوپروپیرادرنالین دکستروچرتاتور (ایزارین) 800 برابر بیشتر از انانتیومر چرخشی آن، برونش گشادکننده است.
رابطه متقابل ساختار استریوشیمیایی با تجلی فعالیت بیولوژیکی. ایزوپروپیرادرنالین دکستروچرتاتور (ایزارین) 800 برابر بیشتر از انانتیومر چرخشی آن، برونش گشادکننده است.

 دیاسترئومرها ایزومرهای فضایی هستند که مولکولهای آنها به عنوان یک جسم و یک تصویر آینه ای ناسازگار با یکدیگر ارتباط ندارند.
دیاسترئومرها ایزومرهای فضایی هستند که مولکولهای آنها به عنوان یک جسم و یک تصویر آینه ای ناسازگار با یکدیگر ارتباط ندارند.

 ایزومر ساختاری ایزومر ساختاری در نتیجه آرایش متفاوت قطعات یک مولکول نسبت به یکدیگر بوجود میآید که با چرخش این بخشها حول یک پیوند ساده C-C که دو اتم را به هم متصل میکند، به دست میآید.
ایزومر ساختاری ایزومر ساختاری در نتیجه آرایش متفاوت قطعات یک مولکول نسبت به یکدیگر بوجود میآید که با چرخش این بخشها حول یک پیوند ساده C-C که دو اتم را به هم متصل میکند، به دست میآید.
 (از زبان lat. conformatio - شکل، آرایش)، اشکال مختلف فضایی که توسط مولکول ها در نتیجه چرخش آزاد قطعات منفرد به دور پیوندهای ساده C-C گرفته شده است.
(از زبان lat. conformatio - شکل، آرایش)، اشکال مختلف فضایی که توسط مولکول ها در نتیجه چرخش آزاد قطعات منفرد به دور پیوندهای ساده C-C گرفته شده است.







 69% 31% کشش واندروالس - به دلیل نیروهای دافعه بین جانشینهای بزرگ بدون ظرفیت.
69% 31% کشش واندروالس - به دلیل نیروهای دافعه بین جانشینهای بزرگ بدون ظرفیت.
در طول درس، شما یک ایده کلی از انواع ایزومر به دست خواهید آورد، یاد خواهید گرفت که ایزومر چیست. با انواع ایزومر در شیمی آلی آشنا شوید: ساختاری و فضایی (استریوایزومریسم). با استفاده از فرمول های ساختاری مواد، زیرگونه های ایزومر ساختاری (ایزومری اسکلتی و موقعیتی) را در نظر بگیرید، با انواع ایزومری فضایی آشنا شوید: هندسی و نوری.
موضوع: مقدمه ای بر شیمی آلی
درس: ایزومریسم. انواع ایزومریسم ایزومری ساختاری، هندسی، نوری
انواع فرمول هایی که قبلا در نظر گرفتیم که مواد آلی را توصیف می کنند نشان می دهد که چندین فرمول ساختاری مختلف می توانند با یک فرمول مولکولی مطابقت داشته باشند.
به عنوان مثال، فرمول مولکولی C2H6Oمطابقت دو مادهبا فرمول های ساختاری مختلف - اتیل الکل و دی متیل اتر. برنج. یکی
اتیل الکل، مایعی که با سدیم فلزی واکنش می دهد و هیدروژن آزاد می کند، در دمای 0+78.5 درجه سانتیگراد می جوشد. تحت همین شرایط، دی متیل اتر، گازی که با سدیم واکنش نمی دهد، در 0-23 درجه سانتیگراد می جوشد.
این مواد از نظر ساختار متفاوت هستند - مواد مختلف با فرمول مولکولی مشابهی مطابقت دارند.
برنج. 1. ایزومری بین طبقاتی
پدیده وجود موادی با ترکیب یکسان، اما ساختار متفاوت و در نتیجه خواص متفاوت، ایزومریسم نامیده می شود (از کلمات یونانی "isos" - "برابر" و "meros" - "بخش"، "سهم").
انواع ایزومریسم
انواع مختلفی از ایزومریسم وجود دارد.
ایزومری ساختاری با ترتیب متفاوتی از اتصال اتم ها در یک مولکول همراه است.
اتانول و دی متیل اتر ایزومرهای ساختاری هستند. از آنجایی که آنها به کلاس های مختلفی از ترکیبات آلی تعلق دارند، این نوع ایزومری ساختاری نامیده می شود همچنین بین طبقاتی . برنج. یکی
ایزومرهای ساختاری همچنین می توانند در همان کلاس از ترکیبات قرار گیرند، به عنوان مثال، فرمول C 5 H 12 مربوط به سه هیدروکربن مختلف است. آی تی ایزومریسم اسکلت کربنی. برنج. 2.

برنج. 2 نمونه هایی از مواد - ایزومرهای ساختاری
ایزومرهای ساختاری با اسکلت کربن یکسان وجود دارند که در موقعیت پیوندهای متعدد (دو و سه گانه) یا اتم هایی که جایگزین هیدروژن می شوند، متفاوت هستند. این نوع ایزومری ساختاری نامیده می شود ایزومریسم موقعیت.
برنج. 3. ایزومری موقعیت سازه
در مولکول هایی که فقط دارای پیوندهای منفرد هستند، چرخش تقریباً آزاد قطعات مولکول به دور پیوندها در دمای اتاق امکان پذیر است و به عنوان مثال، تمام تصاویر فرمول های 1،2-دی کلرواتان معادل هستند. برنج. چهار

برنج. 4. موقعیت اتم های کلر در اطراف یک پیوند
اگر چرخش برای مثال در یک مولکول حلقوی یا با یک پیوند دوگانه دشوار باشد، پس ایزومر هندسی یا سیس ترانس.در ایزومرهای سیس، جانشینها در یک طرف صفحه حلقه یا پیوند دوگانه قرار دارند، در ایزومرهای ترانس آنها در طرف مقابل قرار دارند.
ایزومرهای سیس ترانس زمانی وجود دارند که دو متفاوتقائم مقام. برنج. 5.



برنج. 5. ایزومرهای سیس و ترانس
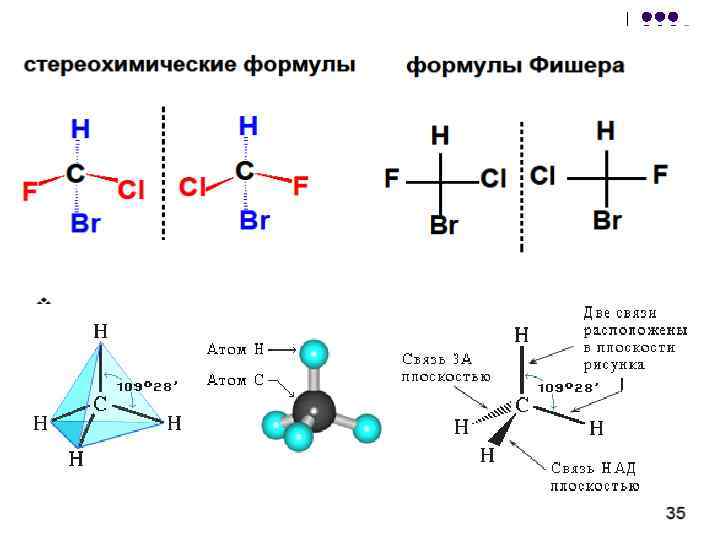
نوع دیگری از ایزومریسم به دلیل این واقعیت به وجود می آید که یک اتم کربن با چهار پیوند منفرد با جایگزین های آن یک ساختار فضایی - یک چهار وجهی تشکیل می دهد. اگر یک مولکول حداقل یک اتم کربن داشته باشد که به چهار جانشین مختلف پیوند خورده باشد، ایزومریسم نوری. چنین مولکول هایی با تصویر آینه ای خود منطبق نیستند. این ویژگی کایرالیتی نامیده می شود - از یونانی باhier- "دست". برنج. 6. ایزومر نوری مشخصه بسیاری از مولکول هایی است که موجودات زنده را تشکیل می دهند.
|
|
|
برنج. 6. نمونه هایی از ایزومرهای نوری
ایزومر نوری نیز نامیده می شود انانتیومرها (از یونانی انانتیوس- «مقابل» و مروس- "بخش")، و ایزومرهای نوری - انانتیومرها . انانتیومرها از نظر نوری فعال هستند، صفحه قطبش نور را با همان زاویه، اما در جهت مخالف می چرخانند: د- ، یا (+) -ایزومر، - به سمت راست، l- ، یا (-) -ایزومر، - به سمت چپ. مخلوطی از مقادیر مساوی انانتیومر نامیده می شود هم نژاد، از نظر نوری غیر فعال است و با نماد نشان داده می شود د، ل- یا (±).
جمع بندی درس
در طول درس، شما یک ایده کلی از انواع ایزومر، یعنی ایزومر به دست آوردید. آشنایی با انواع ایزومر در شیمی آلی: ساختاری و فضایی (استریوایزومریسم). با کمک فرمول های ساختاری مواد، زیرگونه های ایزومر ساختاری (ایزومر اسکلتی و موقعیتی) را در نظر گرفتیم، با انواع ایزومری فضایی: هندسی و نوری آشنا شدیم.
کتابشناسی - فهرست کتب
1. رودزیتیس جی.ای. علم شیمی. مبانی شیمی عمومی. کلاس 10: کتاب درسی برای موسسات آموزشی: سطح پایه / G. E. Rudzitis، F.G. فلدمن - چاپ چهاردهم. - م.: آموزش و پرورش، 2012.
2. شیمی. پایه 10. سطح مشخصات: کتاب درسی. برای آموزش عمومی موسسات / V.V. ارمین، ن.ای. کوزمنکو، وی. لونین و دیگران - م.: درفا، 2008. - 463 ص.
3. شیمی. درجه 11. سطح مشخصات: کتاب درسی. برای آموزش عمومی موسسات / V.V. ارمین، ن.ای. کوزمنکو، وی. لونین و دیگران - م.: درفا، 2010. - 462 ص.
4. Khomchenko G.P.، Khomchenko I.G. مجموعه مسائل شیمی برای ورود به دانشگاه ها. - ویرایش چهارم - M.: RIA "موج جدید": ناشر Umerenkov، 2012. - 278 ص.
مشق شب
1. شماره 1،2 (ص 39) Rudzitis G.E. علم شیمی. مبانی شیمی عمومی. کلاس 10: کتاب درسی برای موسسات آموزشی: سطح پایه / G. E. Rudzitis، F.G. فلدمن - چاپ چهاردهم. - م.: آموزش و پرورش، 2012.
2. چرا تعداد ایزومرهای هیدروکربن های سری اتیلن بیشتر از هیدروکربن های اشباع است؟
3- چه هیدروکربنی هایی ایزومرهای فضایی دارند؟
در طول درس، شما یک ایده کلی از انواع ایزومر به دست خواهید آورد، یاد خواهید گرفت که ایزومر چیست. با انواع ایزومر در شیمی آلی آشنا شوید: ساختاری و فضایی (استریوایزومریسم). با استفاده از فرمول های ساختاری مواد، زیرگونه های ایزومر ساختاری (ایزومری اسکلتی و موقعیتی) را در نظر بگیرید، با انواع ایزومری فضایی آشنا شوید: هندسی و نوری.
موضوع: مقدمه ای بر شیمی آلی
درس: ایزومریسم. انواع ایزومریسم ایزومری ساختاری، هندسی، نوری
انواع فرمول هایی که قبلا در نظر گرفتیم که مواد آلی را توصیف می کنند نشان می دهد که چندین فرمول ساختاری مختلف می توانند با یک فرمول مولکولی مطابقت داشته باشند.
به عنوان مثال، فرمول مولکولی C2H6Oمطابقت دو مادهبا فرمول های ساختاری مختلف - اتیل الکل و دی متیل اتر. برنج. یکی
اتیل الکل، مایعی که با سدیم فلزی واکنش می دهد و هیدروژن آزاد می کند، در دمای 0+78.5 درجه سانتیگراد می جوشد. تحت همین شرایط، دی متیل اتر، گازی که با سدیم واکنش نمی دهد، در 0-23 درجه سانتیگراد می جوشد.
این مواد از نظر ساختار متفاوت هستند - مواد مختلف با فرمول مولکولی مشابهی مطابقت دارند.
برنج. 1. ایزومری بین طبقاتی
پدیده وجود موادی با ترکیب یکسان، اما ساختار متفاوت و در نتیجه خواص متفاوت، ایزومریسم نامیده می شود (از کلمات یونانی "isos" - "برابر" و "meros" - "بخش"، "سهم").
انواع ایزومریسم
انواع مختلفی از ایزومریسم وجود دارد.
ایزومری ساختاری با ترتیب متفاوتی از اتصال اتم ها در یک مولکول همراه است.
اتانول و دی متیل اتر ایزومرهای ساختاری هستند. از آنجایی که آنها به کلاس های مختلفی از ترکیبات آلی تعلق دارند، این نوع ایزومری ساختاری نامیده می شود همچنین بین طبقاتی . برنج. یکی
ایزومرهای ساختاری همچنین می توانند در همان کلاس از ترکیبات قرار گیرند، به عنوان مثال، فرمول C 5 H 12 مربوط به سه هیدروکربن مختلف است. آی تی ایزومریسم اسکلت کربنی. برنج. 2.

برنج. 2 نمونه هایی از مواد - ایزومرهای ساختاری
ایزومرهای ساختاری با اسکلت کربن یکسان وجود دارند که در موقعیت پیوندهای متعدد (دو و سه گانه) یا اتم هایی که جایگزین هیدروژن می شوند، متفاوت هستند. این نوع ایزومری ساختاری نامیده می شود ایزومریسم موقعیت.
برنج. 3. ایزومری موقعیت سازه
در مولکول هایی که فقط دارای پیوندهای منفرد هستند، چرخش تقریباً آزاد قطعات مولکول به دور پیوندها در دمای اتاق امکان پذیر است و به عنوان مثال، تمام تصاویر فرمول های 1،2-دی کلرواتان معادل هستند. برنج. چهار

برنج. 4. موقعیت اتم های کلر در اطراف یک پیوند
اگر چرخش برای مثال در یک مولکول حلقوی یا با یک پیوند دوگانه دشوار باشد، پس ایزومر هندسی یا سیس ترانس.در ایزومرهای سیس، جانشینها در یک طرف صفحه حلقه یا پیوند دوگانه قرار دارند، در ایزومرهای ترانس آنها در طرف مقابل قرار دارند.
ایزومرهای سیس ترانس زمانی وجود دارند که دو متفاوتقائم مقام. برنج. 5.



برنج. 5. ایزومرهای سیس و ترانس
نوع دیگری از ایزومریسم به دلیل این واقعیت به وجود می آید که یک اتم کربن با چهار پیوند منفرد با جایگزین های آن یک ساختار فضایی - یک چهار وجهی تشکیل می دهد. اگر یک مولکول حداقل یک اتم کربن داشته باشد که به چهار جانشین مختلف پیوند خورده باشد، ایزومریسم نوری. چنین مولکول هایی با تصویر آینه ای خود منطبق نیستند. این ویژگی کایرالیتی نامیده می شود - از یونانی باhier- "دست". برنج. 6. ایزومر نوری مشخصه بسیاری از مولکول هایی است که موجودات زنده را تشکیل می دهند.
|
|
|
برنج. 6. نمونه هایی از ایزومرهای نوری
ایزومر نوری نیز نامیده می شود انانتیومرها (از یونانی انانتیوس- «مقابل» و مروس- "بخش")، و ایزومرهای نوری - انانتیومرها . انانتیومرها از نظر نوری فعال هستند، صفحه قطبش نور را با همان زاویه، اما در جهت مخالف می چرخانند: د- ، یا (+) -ایزومر، - به سمت راست، l- ، یا (-) -ایزومر، - به سمت چپ. مخلوطی از مقادیر مساوی انانتیومر نامیده می شود هم نژاد، از نظر نوری غیر فعال است و با نماد نشان داده می شود د، ل- یا (±).
جمع بندی درس
در طول درس، شما یک ایده کلی از انواع ایزومر، یعنی ایزومر به دست آوردید. آشنایی با انواع ایزومر در شیمی آلی: ساختاری و فضایی (استریوایزومریسم). با کمک فرمول های ساختاری مواد، زیرگونه های ایزومر ساختاری (ایزومر اسکلتی و موقعیتی) را در نظر گرفتیم، با انواع ایزومری فضایی: هندسی و نوری آشنا شدیم.
کتابشناسی - فهرست کتب
1. رودزیتیس جی.ای. علم شیمی. مبانی شیمی عمومی. کلاس 10: کتاب درسی برای موسسات آموزشی: سطح پایه / G. E. Rudzitis، F.G. فلدمن - چاپ چهاردهم. - م.: آموزش و پرورش، 2012.
2. شیمی. پایه 10. سطح مشخصات: کتاب درسی. برای آموزش عمومی موسسات / V.V. ارمین، ن.ای. کوزمنکو، وی. لونین و دیگران - م.: درفا، 2008. - 463 ص.
3. شیمی. درجه 11. سطح مشخصات: کتاب درسی. برای آموزش عمومی موسسات / V.V. ارمین، ن.ای. کوزمنکو، وی. لونین و دیگران - م.: درفا، 2010. - 462 ص.
4. Khomchenko G.P.، Khomchenko I.G. مجموعه مسائل شیمی برای ورود به دانشگاه ها. - ویرایش چهارم - M.: RIA "موج جدید": ناشر Umerenkov، 2012. - 278 ص.
مشق شب
1. شماره 1،2 (ص 39) Rudzitis G.E. علم شیمی. مبانی شیمی عمومی. کلاس 10: کتاب درسی برای موسسات آموزشی: سطح پایه / G. E. Rudzitis، F.G. فلدمن - چاپ چهاردهم. - م.: آموزش و پرورش، 2012.
2. چرا تعداد ایزومرهای هیدروکربن های سری اتیلن بیشتر از هیدروکربن های اشباع است؟
3- چه هیدروکربنی هایی ایزومرهای فضایی دارند؟
سیس ترانس-ایزومریسمیا ایزومریسم هندسی- یکی از انواع استریوایزومریسم: این امکان وجود دارد که جانشین ها در یک یا در طرف مقابل صفحه پیوند دوگانه یا حلقه غیر آروماتیک قرار گیرند. همه ایزومرهای هندسی دیاسترئومر هستند، زیرا تصاویر آینه ای از یکدیگر نیستند. سیس- و ترنسایزومرها هم در بین ترکیبات آلی و هم در بین مواد معدنی یافت می شوند. مفاهیم سیسو ترنسدر مورد conformer ها استفاده نمی شود، دو هندسه که به راحتی به یکدیگر جریان می یابند، به جای آن از عناوین "syn" و "anti" استفاده می شود.
نامگذاری « سیس"و" ترنس» از لاتین آمده، از این زبان ترجمه شده است سیسبه معنی "یک طرف" و ترنس- "در طرف دیگر" یا "مقابل". اصطلاح "ایزومری هندسی" بر اساس IUPAC یک مترادف منسوخ در نظر گرفته می شود سیس-ترنس-ایزومریسم
باید به خاطر داشت که سیس ترانس- نامگذاری توصیف می کند نسبت فامیلیترتیب جایگزین ها، و نباید با آنها اشتباه گرفته شود E, Z- نامگذاری که می دهد مطلقتوصیف استریوشیمیایی و فقط برای آلکن ها کاربرد دارد.
سیس ترانسترکیبات آلی حلقه ای نیز ایزومریسم را نشان می دهند که در آن جانشین ها می توانند در یک یا در طرف مقابل صفحه حلقه قرار گیرند. یک مثال 1،2-دی کلرو سیکلوهگزان است:
 |
  |
| ترنس-1،2-دی کلرو سیکلوهگزان | سیس-1،2-دی کلرو سیکلوهگزان |
 |
 |
| سیس-2-پنتن | ترنس-2-پنتن |
 |
 |
| سیس-1،2-دی کلرواتیلن | ترنس-1،2-دی کلرواتیلن |
 |
 |
| سیس- اسید بوتندیوئیک (مالئیک اسید) |
ترنس- اسید بوتندیوئیک (اسید فوماریک) |
 |
 |
| اسید اولئیک | اسید الایدیک |
تفاوتها میتواند ظریف باشد، همانطور که در مورد نقطه جوش آلکنهای زنجیره مستقیم مانند 2-پنتن وجود دارد. سیس-ایزومری که در دمای 37 درجه سانتی گراد می جوشد و ترنسایزومر - در 36 درجه سانتیگراد. تفاوت بین سیس- و ترنس- در صورت وجود پیوندهای پلاریزه در مولکول، مانند 1،2-دی کلرواتیلن، حتی بیشتر می شود. سیس-ایزومر در این مورد در 60.3 درجه سانتیگراد می جوشد، اما ترنس-ایزومر در 47.5 درجه سانتیگراد می جوشد. چه زمانی سیساثر ایزومر از دو پیوند C-Cl قطبی با هم جمع میشود و یک دوقطبی مولکولی قوی را تشکیل میدهد که منجر به برهمکنشهای بین مولکولی قوی (نیروهای Keesom) میشود که به نیروهای پراکندگی اضافه میشود و منجر به افزایش نقطه جوش میشود. AT ترنسایزومر، برعکس، این اتفاق نمی افتد، زیرا دو گشتاور پیوندهای C-Cl در مقابل یکدیگر قرار دارند و بدون ایجاد یک گشتاور دوقطبی اضافی، یکدیگر را خنثی می کنند (اگرچه گشتاور چهار قطبی آنها اصلاً صفر نیست).
دو ایزومر هندسی اسید بوتندیوئیک از نظر خواص و واکنش پذیری آنقدر متفاوت هستند که حتی نام های متفاوتی نیز دارند: سیس-ایزومر اسید مالئیک نامیده می شود و ترنسایزومر - اسید فوماریک. خاصیت کلیدی که نقطه جوش نسبی را تعیین می کند، قطبیت مولکول است، زیرا برهمکنش های بین مولکولی را افزایش می دهد و در نتیجه نقطه جوش را افزایش می دهد. به همین ترتیب، تقارن نقطه ذوب را تعیین می کند، زیرا مولکول های متقارن در حالت جامد بهتر بسته می شوند، حتی اگر قطبیت مولکول تغییر نکند. یکی از نمونههای این وابستگی، اسیدهای اولئیک و الیدیک است. اسید اولئیک، سیسایزومر، نقطه ذوب 13.4 درجه سانتیگراد دارد و در دمای اتاق به مایع تبدیل می شود، در حالی که ترنسایزومر، اسید الیدیک، دارای نقطه ذوب بالاتر 43 درجه سانتیگراد است زیرا مستقیم تر است. ترنسایزومر بسته بندی متراکم تری دارد و در دمای اتاق جامد باقی می ماند.
سیس ترانسایزومرهای اسیدهای دی کربوکسیلیک نیز از نظر اسیدی متفاوت هستند: اسید مالئیک ( سیس) اسید بسیار قوی تر از فوماریک است ( ترنس). بنابراین، اولین ثابت تفکیک برای اسید فوماریک pK a1= 3.03 و برای اسید مالئیک pK a1= 1.9. برعکس، ثابت تفکیک دومین گروه کربوکسیل برای اسید فوماریک بیشتر از اسید مالئیک است، یعنی: برای اسید فوماریک. pK a2= 4.44 و برای اسید مالئیک pK a2= 6.07. به دلیل مجاورت فضایی گروه های کربوکسیل در سیس- در صورت تمایل، تمایل هیدروژن به یونیزه شدن افزایش می یابد، بنابراین اولین ثابت اسید مالئیک بیشتر است. با این حال، برای پروتون دوم دشوارتر است که بر جاذبه دو گروه کربوکسیل نزدیک غلبه کند سیسایزومر، بنابراین دومین ثابت تفکیک اسید مالئیک کمتر از اسید فوماریک است. یک اصل مشابه برای اسیدهای دی کربوکسیلیک آلی سیکلیک اعمال می شود، با این حال، با افزایش اندازه حلقه، تأثیر شکل حلقه غیرمسطح نیز باید در نظر گرفته شود.
ثابت جفت شدن اسپین-اسپین هسته ای مجاور (3 جی HH) اندازه گیری شده توسط طیف سنجی NMR، بیشتر برای ترنس-ایزومرها (محدوده: 12-18 هرتز؛ متوسط: 15 هرتز) نسبت به سیسایزومرها (محدوده: 0-12 هرتز؛ متوسط: 8 هرتز).
به عنوان یک قاعده برای سیستم های غیر چرخه ای ترنس سیس. دلیل این امر معمولاً افزایش فعل و انفعالات فضایی ناخواسته جانشینهای با فاصله نزدیک در سیس-ایزومر به همین دلیل، گرمای ویژه احتراق ترنس-ایزومرهای کمتر از سیسکه نشان دهنده پایداری ترمودینامیکی بیشتر است. استثناهای این قانون عبارتند از: 1،2-دی فلوئورواتیلن، 1،2-دی فلورودیازن (FN=NF)، 1-بروموپروپن-1، و چندین اتیلن جایگزین هالوژن و اکسیژن دیگر. در این مورد سیس-ایزومر پایدارتر از ترنسایزومر، زیرا بین چنین جانشینهایی نیروهای دافعه غالب نیستند، بلکه نیروهای جذاب (مانند نیروهای لندن) وجود دارند. علاوه بر این، به دلیل حجم نسبتاً کم جانشین ها، مانع فضایی ایجاد نمی شود. از بین 1،2-دی هالواتیلن ها، تنها 1،2-دی یدو اتیلن دارای ایزومر ترانس پایدارتر از سیسایزومر، زیرا به دلیل شعاع زیاد، اگر اتم های ید در یک سمت پیوند دوگانه قرار گیرند، برهمکنش فضایی قوی را تجربه می کنند.
ایزومرهای هندسی، که تفاوت آنها به موقعیت جانشین ها در اطراف پیوند دوگانه مربوط می شود، با اشکال استریو ایزومری از نوع متفاوت - کنفورمرها متفاوت است. وجود جدا سیس- و ترنسایزومرها، در اصل، تنها به دلیل سد انرژی بالای چرخش حول پیوند دوگانه امکان پذیر است، که امکان جداسازی وجود را فراهم می کند. سیس- و ترنسایزومرها، در حالی که کنفورمرها فقط به شکل یک مخلوط تعادلی وجود دارند. مقدار مانع چرخش حول پیوند دوگانه در آلکن های ساده 250-270 کیلوژول بر مول است. با این حال، اگر الکترون دهنده های قوی (-SR) در یک طرف قرار گیرند، و گروه ها، گیرنده های الکترون قوی (-CN، -COC 6 H 5) در طرف دیگر قرار گیرند، بنابراین پیوند دوگانه قطبی می شود، این منجر به یک کاهش مانع چرخش مانع چرخش حول یک پیوند که بدین ترتیب قطبی شده است را می توان به 60-100 کیلوژول بر مول کاهش داد. موانع انرژی کم زمانی که تفاوت انرژی بین سیس ترانسایزومرها و کنفورمرها برای مشتقات آمین استر استواستیک و انامینوکتونها هموار میشوند. نشان داده شده است که موقعیت تعادل در چنین سیستم هایی به ماهیت حلال بستگی دارد. بنابراین، انامینوکتونها در حلالهای غیرقطبی 100% در آن وجود دارند سیس- شکل تثبیت شده توسط پیوند هیدروژنی داخلی و در حلال های قطبی تا 50٪ ترنس-تشکیل می دهد.
سیستم نشانه گذاری سیس-ترنسفقط برای نامگذاری آلکنهای ایزومر با دو نوع جایگزین مختلف در پیوند دوگانه به خوبی قابل استفاده است، در مولکولهای پیچیده، چنین نامگذاری بسیار مبهم میشود. در این موارد، IUPAC توسعه یافته است E,ز- نمادی که به طور منحصر به فرد نام ترکیبات را برای همه موارد ممکن تعریف می کند، و بنابراین به ویژه برای نام گذاری آلکن های سه و چهار جایگزین مفید است. این سیستم از سردرگمی در مورد اینکه کدام گروه باید در نظر گرفته شود جلوگیری می کند. سیس- یا ترنس- در رابطه با یکدیگر.
اگر دو گروه قدیمی در یک طرف پیوند دوگانه قرار گیرند، یعنی در آن قرار دارند سیس- موقعیت نسبت به یکدیگر، پس چنین ماده ای نامیده می شود ز-ایزومر (از آلمانی zusammen - با هم). وقتی گروههای قدیمیتر در طرف مقابل پیوند دوگانه قرار دارند (در ترنس-orientation)، سپس چنین ایزومری نامیده می شود E-ایزومر (از آلمانی entgegen - مقابل). ترتیب تقدم گروه ها و اتم ها با قوانین کان - اینگولد - پریلوگ تعیین می شود. برای هر یک از دو اتم موجود در پیوند دوگانه، لازم است که قدمت هر جایگزین تعیین شود. اگر هر دو جایگزین اصلی در یک سمت صفحه پیوند π قرار داشته باشند، این پیکربندی با نماد نشان داده می شود. ز، اگر این گروه ها در طرف مقابل صفحه پیوند π باشند، پیکربندی با نماد نشان داده می شود. E .
لازم به ذکر است که سیس/ترنسو E,زبنابراین، نامگذاریها مبتنی بر مقایسه جایگزینهای مختلف آلکنها است ز-ایزومر همیشه مطابقت ندارد سیس-ایزومر، و Eایزومر - ترنس-ایزومر مثلا، ترنس-2-کلروبوتن-2 (دو گروه متیل C1 و C4، در زنجیره اصلی بوتن-2a در ترنس- جهت گیری) است ( ز)-2-کلروبوتن-2 (کلر قدیمی تر از متیل است که به نوبه خود از هیدروژن قدیمی تر است، بنابراین کلر و C4-متیل با هم در نظر گرفته می شوند).
سیس–ترنسایزومریسم همچنین در ترکیبات معدنی، عمدتاً در دیازن ها و ترکیبات پیچیده یافت می شود.
دیازن ها (و دی فسفن های مرتبط) به نمایش گذاشته می شوند cis-trans-ایزومریسم همانطور که در مورد ترکیبات آلی، سیسایزومر واکنش پذیرتر است، فقط می تواند آلکن ها و آلکین ها را به آلکان تبدیل کند. ترنسایزومر، که به آلکن نزدیک می شود، نمی تواند اتم های هیدروژن خود را برای کاهش موثر آلکن ردیف کند. سیس-ایزومر به دلیل فرم مناسب با موفقیت با این کار کنار می آید.
  |
  |
| ترنس- دیازن | سیس- دیازن |
ترکیبات هماهنگ غیر آلی با هندسه هشت وجهی یا مربع مسطح نیز به زیر تقسیم می شوند. سیس-ایزومرهایی که لیگاندهای مشابه در کنار هم قرار دارند و ترنسایزومرهایی که در آن لیگاندها از یکدیگر جدا شده اند.
به عنوان مثال، دو ایزومر هندسی مسطح مربعی برای Pt(NH 3) 2 Cl 2 وجود دارد، پدیده ای که آلفرد ورنر در سال 1893 توضیح داد. سیس-ایزومر با نام کامل سیسدی کلرودی آمین پلاتین (II) دارای فعالیت ضد توموری است که توسط بارنت روزنبرگ در سال 1969 نشان داده شد. اکنون این ماده در شیمی درمانی با نام کوتاه سیس پلاتین شناخته می شود. ترنسبرعکس، ایزومر (ترانس پلاتین) هیچ گونه فعالیت دارویی ندارد. هر یک از این ایزومرها را می توان بر اساس اثر ترانس سنتز کرد که به دست آوردن عمدتاً ایزومر مورد نظر را ممکن می کند.
 |
 |
|
سیس- + و ترنس- + |
||
برای کمپلکس های هشت وجهی با فرمول MX 4 Y 2، دو ایزومر نیز وجود دارد. (در اینجا M یک اتم فلز است و X و Y انواع مختلفی از لیگاندها هستند.) سیسایزومر، دو لیگاند Y با زاویه 90 درجه مجاور یکدیگر هستند، همانطور که برای اتم های کلر در نشان داده شده است. سیس- + در تصویر سمت چپ. AT ترنسایزومر، که در سمت راست نشان داده شده است، دو اتم کلر در انتهای مخالف قطر قرار دارند که از اتم مرکزی کبالت عبور می کند.
نوع مشابهی از ایزومریسم کمپلکس های هشت وجهی MX 3 Y 3 است سیستم عامل بزرگ-ایزومریسم یا ایزومری محوری صورت، زمانی که تعداد معینی لیگاند در آن باشد سیس- یا ترنس- موقعیت نسبت به یکدیگر AT بزرگایزومرها، لیگاندهایی از همان نوع رئوس وجه مثلثی هشت وجهی را اشغال می کنند و در سیستم عاملایزومرها، لیگاندهای یکسان در سه موقعیت مجاور قرار دارند به طوری که دو لیگاند در طرف مقابل اتم مرکزی و در یک محور با آن قرار دارند.
ایزومرهای هندسی زمانی به وجود می آیند که چرخش آزاد اتم ها در یک مولکول به دلیل وجود یک پیوند دوگانه محدود شود. اسیدهای مالئیک (12.23) و فوماریک (12.24) (به ترتیب سیس و ترانس) می توانند به عنوان نمونه ای از این جفت ایزومرها باشند.
ایزومرهای هندسی از نظر ساختار شیمیایی بسیار شبیه هم هستند، اما تصویر آینه ای از یکدیگر نیستند و صفحه قطبش نور را نمی چرخانند. به عنوان یک قاعده، ایزومرهای سیس و ترانس به طور قابل توجهی در خواص فیزیکی متفاوت هستند. به عنوان مثال، اسید مالئیک (12.23) در دمای 130 درجه سانتیگراد ذوب می شود، مقدار pKa آن 1.9 است، در آب سرد بسیار محلول است (79 گرم در 100 میلی لیتر). ثابت های ایزومر هندسی آن - اسید فوماریک (12.24) به ترتیب 287 درجه سانتیگراد، 3.0 و 0.7 گرم در 100 میلی لیتر است. تعجب آور نیست که ایزومرهای هندسی دارای خواص بیولوژیکی متفاوتی هستند و بنابراین هنگام مطالعه فرمول شیمیایی یک ترکیب جدید بسیار مهم است که تمام احتمالات وجود این نوع ایزومریسم را در نظر بگیریم.
ایزومرهای سیس و ترانس را می توان به راحتی با کریستالیزاسیون یا کروماتوگرافی جدا کرد. هیچ روش کلی برای تبدیل یک ایزومر به ایزومر دیگر وجود ندارد، اما گرم کردن معمولا پایدارترین ایزومر را تولید می کند، در حالی که قرار گرفتن در معرض نور باعث تولید ایزومر کمتر می شود. بینایی انسان به تبدیل ایزومر 11-cis شبکیه به شکل 11-trans تحت تأثیر نور بستگی دارد. به محض ناپدید شدن پرتو هیجان انگیز نور،
این رنگدانه کاروتنوئیدی دوباره به شکل سیس می رود و در نتیجه حرکت به مغز را قطع می کند.ایزومرهای سیس و ترانس نیز در حلقه مسطح سیکلوپنتان وجود دارند که به عنوان یک پیوند دوگانه بزرگ است. اگرچه حلقه سیکلوهگزان اصلاً مسطح نیست، با این وجود به اندازه کافی مسطح است تا ایزومرهای سیس و ترانس را تشکیل دهد. بنابراین، هر دو شکل cis- (12.25) و trans- (12.26) دی آمینو سیکلوهگزان وجود دارد و در دسترس است. یک مولکول می تواند هم ایزومرهای هندسی و هم ایزومرهای نوری را تشکیل دهد. به عنوان مثال، ایزومر ترانس (12.26) را می توان به ایزومرهای کایرال (S,S) (12.27) و (R.R) (12.28) جدا کرد. با این حال، ایزومر سیس را نمی توان به اشکال کایرال تقسیم کرد، زیرا دارای صفحه تقارن است. حلقه بنزن هیچ ایزومر هندسی ندارد، زیرا هر اتم کربن حلقه تنها یک جانشین دارد.
Cis-Trans- TpaHC-(S S) TpaHC-(R.R) (12.25) (12.26) (12.27) (12.28) |
استریو ایزومرهای 1،2-دی آمینوسینلوژنسان
گاهی اوقات انتخاب دو مورد از چهار جایگزین روی یک پیوند دوگانه برای تعیین پیکربندی cis یا trans دشوار است. قانون توالی انتخاب جانشین هایی را با سنگین ترین اتم ها تجویز می کند، در حالی که شکل cis با حرف Z (از کلمه آلمانی zusammen) و تبدیل با حرف E (entgegen) نشان داده می شود. گاهی اوقات در نام ترکیباتی که ایزومری هندسی می تواند به طور مکرر خود را نشان دهد، جانشینی که کمترین عدد را دارد (طبق قانون شماره گذاری) با حرف r و نام های c-(cis) و t-(trans) نشان داده می شود. در مقابل سایر جانشینان جایگاه خود را نسبت به آقای معاون نشان می دهند.
مشابه اسید ایندول-3-ایلاستیک (4.82) که رشد سلول های گیاهی را تحریک می کند، سایر اسیدهای کربوکسیلیک نیز می توانند عمل کنند که گروه کربوکسیل آنها نسبت به صفحه حلقه معطر زاویه دارد. ایزومر هندسی امکان چنین آرایش دو جایگزین را محدود می کند، بنابراین، از اسیدهای سینامیک، فقط ایزومر سیس فعال است. در اسیدهای 2-فنیل سیکلوپروپان-1-کربوکسیلیک و 1،2،3،4-تتراهیدرونفتالیدین-هوستیک، فقط سیس ایزومرها نیز فعال هستند. مدلهای مولکولی نشان میدهند که حلقه و گروه کربوکسیل در ایزومر ترانس (غیر فعال) این مواد در یک صفحه قرار دارند، در حالی که در شکل سیس (فعال) همسطح نیستند. او اولین کسی بود که به این رابطه بین غیرهمسطح بودن و فعالیت محرک رشد Veidstra اشاره کرد. غیرهمسطحی نیز می تواند به دلیل موانع فضایی ایجاد شود. بنابراین، اسید بنزوئیک شکل صافی دارد و فعال نیست، در حالی که اسیدهای 2،6-دی کلروبنزوئیک و 8-متیل-1-نفتوئیک غیرمسطح و از نظر بیولوژیکی فعال هستند.
در آنالوگ های اکسین ها، گروه کربوکسیل را می توان با سایر گروه های الکترون گیر (-CN، -N02، -SO3H) جایگزین کرد، در حالی که فعالیت بیولوژیکی فقط اندکی کاهش می یابد. برای ارتباط بین ساختار و عمل در این مجموعه، به Koepfli، Thimann، Went (1938) و Veidstra مراجعه کنید.
ایزومری هندسی استروئیدها شایسته توجه ویژه است. فرمول (12.29) ساختار کلی این گروه از ترکیبات اشباع طبیعی را نشان می دهد (شماره اتم های کربن و حروف چهار چرخه نشان داده شده است). در استروئیدهای طبیعی، حلقههای B و C در یک اتصال متقابل قرار دارند که هر دو به شکل صندلی متصل میشوند. در گلیکوزیدهای قلبی، محل اتصال چرخه های C و D دارای پیکربندی cis است، اما در هورمون های حیوانی، استرول ها و اسیدهای صفراوی، دارای یک اتصال ترانس است. در بیشتر استروئیدهای فعال بیولوژیکی، حلقههای A و B در یک اتصال متقابل هستند (ردیف "5a" که قبلا "allo" نامیده میشد). هر یک از حلقه های موجود در مولکول استروئید چین هایی را تشکیل می دهد که در برآمدگی جانبی فرمول (12.30) به وضوح دیده می شود.
نام "5a" نشان می دهد که اتم هیدروژن در موقعیت 5 زیر صفحه مشترک حلقه ها قرار دارد. همه جانشین های واقع در زیر این صفحه با نماد "a" و در بالا - با نماد نشان داده شده در فرمول های (12.34) و (12.35) نشان داده می شوند.
شکل صندلی کمترین تنش را دارد و بنابراین برای مولکول سیکلوهگزان ترجیح داده می شود، به طوری که هر اتم هیدروژن محوری 0.25 نانومتر از دو اتم هیدروژن محوری دیگر واقع در همان سمت چرخه حذف می شود. شکل پیچ خورده (یا پیچ خورده) یک موقعیت متوسط را اشغال می کند (بین شکل صندلی و قایق)، و استرس زاترین شکل وان حمام است. با این حال، دومی ممکن است توسط دو یا چند حلقه ذوب شده حاوی جایگزینهای مناسب تثبیت شود. مولکول دکاهیدرونفتالین (دکالین) می تواند به دو شکل پایدار وجود داشته باشد که ساختار آن با پراش الکترونی تعیین شد که نشان داد شکل ترانس (نقطه ذوب -30 درجه سانتیگراد، نقطه جوش 117 درجه سانتیگراد در 100 میلی متر جیوه) متشکل از دو حلقه ترانس ذوب شده در ساختار صندلی، و شکل سیس (نقطه ذوب -43 درجه سانتیگراد، نقطه جوش 124 درجه سانتیگراد در 100 میلی متر جیوه) از دو حلقه سیس ذوب شده در ساختار صندلی تشکیل شده است. فرم سیس در دمای بالا و در حضور کاتالیزور به فرم ترانس تبدیل می شود. مولکول دکالین نمونه ای از ایزومریسم هندسی با توجه به کربن های پل زدنی است، اما هر چرخه از نظر ساختاری متحرک باقی می ماند.
مورد توجه تجزیه و تحلیل ساختاری پیوند -CO-H- است که ساختار پپتیدها را تعیین می کند. در پروتئین ها، ترکیب آن همیشه "گسترش یافته" (ترانس) است، اگرچه در پپتیدهای حاوی پرولین، به عنوان مثال، یک گروه آمید درجه سوم، نسبت ترکیب "مبهم" (cis) تعادل بسیار بزرگ است (تا 40٪). در فرمامیدهای ثانویه، مخلوط تعادلی از کنفورمرهای "گسترش یافته" و "معروف" به نسبت 8:92 در مورد N-متیل فرمامید (12.39، 12.40) وجود دارد. وجود آنها با حضور دو سیگنال مجزا در طیف PMR مشخص شد. با افزایش حجم جانشین در اتم نیتروژن، نسبت کنفورمر "بسط یافته" افزایش می یابد و زمانی که گروه متیل با ترت بوتیل جایگزین می شود به 18٪ می رسد.