
cis-trans-isomeeria või geomeetriline isomeeria- üks stereoisomerismi tüüpidest: see seisneb võimaluses, et asendajad paiknevad kaksiksideme või mittearomaatse tsükli tasapinna ühel või vastaskülgedel. Kõik geomeetrilised isomeerid on diastereomeerid, kuna need ei ole üksteise peegelpildid. cis- ja transs-isomeere leidub nii orgaaniliste kui ka anorgaaniliste ühendite hulgas. Mõisted cis ja transs ei kasutata konformeeride puhul, kaks kergesti üksteisesse voolavat geomeetriat, nende asemel kasutatakse tähiseid "syn" ja "anti".
Nimetused « cis" ja " transs» tuli ladina keelest, sellest keelest tõlgituna cis tähendab "ühel küljel" ja transs- "teisel pool" või "vastupidi". Mõistet "geomeetriline isomeeria" peetakse IUPAC-i järgi vananenud sünonüümiks cis-transs-isomeeria.
Seda tuleks meeles pidada cis-trans- kirjeldab nomenklatuur sugulane asendajate paigutus ja seda ei tohiks segi ajada E,Z- nomenklatuur, mis annab absoluutne stereokeemiline kirjeldus ja kehtib ainult alkeenide kohta.
cis-trans Alitsüklilistel ühenditel on ka -isomeeria, milles asendajad võivad paikneda tsükli tasapinna ühel või vastaskülgedel. Näiteks on 1,2-diklorotsükloheksaan:
 |
  |
| transs-1,2-diklorotsükloheksaan | cis-1,2-diklorotsükloheksaan |
 |
 |
| cis-2-penteen | transs-2-penteen |
 |
 |
| cis-1,2-dikloroetüleen | transs-1,2-dikloroetüleen |
 |
 |
| cis-buteendioonhape (maleiinhape) |
transs-buteendioonhape (fumaarhape) |
 |
 |
| Oleiinhape | Elaidiinhape |
Erinevused võivad olla väikesed, nagu see on sirge ahelaga alkeenide, näiteks 2-penteeni keemistemperatuuri puhul. cis-isomeer, mille keeb temperatuuril 37 °C, ja transs-isomeer - 36 °C juures. Erinevus vahel cis- ja transs- muutub veelgi suuremaks, kui molekulis on polariseeritud sidemeid, nagu 1,2-dikloroetüleen. cis-isomeer keeb sel juhul temperatuuril 60,3 °C, kuid transs-isomeer keeb temperatuuril 47,5 °C. Millal cis-isomeeride efekt kahest polaarsest C-Cl sidemest moodustab tugeva molekulaarse dipooli, mis tekitab tugevaid molekulidevahelisi interaktsioone (Keesomi jõud), mis suurendavad dispersioonijõude ja põhjustavad keemistemperatuuri tõusu. AT transs-isomeer, vastupidi, seda ei juhtu, kuna C-Cl sidemete kaks momenti asuvad üksteise vastas ja tühistavad üksteist täiendavat dipoolmomenti tekitamata (kuigi nende kvadrupoolmoment pole üldse null).
Buteendihappe kaks geomeetrilist isomeeri on oma omaduste ja reaktsioonivõime poolest nii erinevad, et neil on isegi erinevad nimed: cis-isomeeri nimetatakse maleiinhappeks ja transs-isomeer - fumaarhape. Peamine omadus, mis määrab suhtelise keemistemperatuuri, on molekuli polaarsus, kuna see suurendab molekulidevahelisi interaktsioone, tõstes seeläbi keemistemperatuuri. Samamoodi määrab sümmeetria sulamistemperatuuri, kuna sümmeetrilised molekulid pakendavad tahkes olekus paremini, isegi kui molekuli polaarsus ei muutu. Sellise sõltuvuse üheks näiteks on oleiin- ja elaidiinhape; oleiinhape, cis-isomeer, sulamistemperatuur on 13,4 °C ja muutub toatemperatuuril vedelaks, samas transs-isomeeri, elaidiinhappe sulamistemperatuur on kõrgem, 43 °C, kuna see on otsesem transs-isomeeri tihend on tihedam ja püsib toatemperatuuril tahke.
cis-trans-dikarboksüülhapete isomeerid erinevad ka happesuse poolest: maleiinhape ( cis) on oluliselt tugevam hape kui fumaar ( transs). Niisiis, fumaarhappe esimene dissotsiatsioonikonstant pK a1= 3,03 ja maleiinhappe jaoks pK a1= 1,9. Vastupidi, fumaarhappe teise karboksüülrühma dissotsiatsioonikonstant on suurem kui malehappe puhul, nimelt: fumaarhappe puhul. pK a2= 4,44 ja maleiinhappe jaoks pK a2= 6,07. Karboksüülrühmade ruumilise läheduse tõttu cis- vorm, suureneb vesiniku kalduvus ioniseerida, seega on malehappe esimene konstant suurem. Teisel prootonil on aga keerulisem ületada kahe lähedase karboksüülrühma külgetõmbejõudu cis-isomeer, seega on maleiinhappe teine dissotsiatsioonikonstant väiksem kui fumaarhappel. Sarnane põhimõte kehtib ka alitsükliliste dikarboksüülhapete kohta, kuid tsükli suuruse suurenedes tuleks arvesse võtta ka mittetasapinnalise rõnga kuju mõju.
Vicinaalne tuuma spin-spin sidestuskonstant (3 J HH) mõõdetud NMR-spektroskoopiaga, rohkem transs-isomeerid (vahemik: 12-18 Hz; keskmine: 15 Hz) kui jaoks cis-isomeerid (vahemik: 0-12 Hz; keskmine: 8 Hz).
Reeglina atsükliliste süsteemide jaoks transs cis. Selle põhjuseks on tavaliselt tihedalt asetsevate asendajate soovimatute steeriliste interaktsioonide tugevdamine cis-isomeer. Samal põhjusel ka eripõlemissoojus transs-isomeerid madalamad kui cis, mis näitab suuremat termodünaamilist stabiilsust. Selle reegli erandid on 1,2-difluoroetüleen, 1,2-difluorodiaseen (FN=NF), 1-bromopropeen-1 ja mitmed teised halogeen- ja hapnikuasendatud etüleenid. Sel juhul cis-isomeer on stabiilsem kui transs-isomeer, kuna selliste asendajate vahel ei domineeri mitte tõukejõud, vaid tõmbejõud (näiteks Londoni jõud). Lisaks ei teki asendajate suhteliselt väikese mahu tõttu steerilisi takistusi. 1,2-dihaloetüleenidest on ainult 1,2-dijodoetüleenil stabiilsem trans-isomeer kui cis-isomeer, sest suure raadiuse tõttu kogevad joodiaatomid tugevat ruumilist vastasmõju, kui nad asuvad kaksiksidemega samal küljel.
Geomeetrilised isomeerid, mille erinevus on seotud kaksiksideme ümber olevate asendajate asendiga, erinevad erinevat tüüpi stereoisomeeridest - konformeeridest. Eraldi olemasolu cis- ja transs-isomeerid on sisuliselt võimalikud ainult tänu kõrgele kaksiksideme ümber pöörleva energiabarjäärile, mis võimaldab eraldada olemasolu cis- ja transs-isomeerid, samas kui konformeerid eksisteerivad ainult tasakaalulise seguna. Topeltsideme ümber pöörleva tõkke väärtus lihtsates alkeenides on 250-270 kJ/mol. Kui aga tugevad elektronidoonorid (-SR) asetatakse ühele küljele ja rühmad, tugevad elektroni aktseptorid (-CN, -COC 6 H 5) asetatakse teisele poole, polariseerides nii kaksiksidet, toob see kaasa märkimisväärse pöörlemisbarjääri vähenemine. Sel viisil polariseeritud sideme ümber pöörlemise takistust saab vähendada 60-100 kJ/mol-ni. Madalad energiatõkked, kui energia erinevus cis-trans-isomeerid ja konformeerid on silutud, leitud atsetoäädikhappe estri ja enaminoketoonide amiini derivaatide puhul. On näidatud, et sellistes süsteemides olev tasakaaluasend sõltub lahusti olemusest. Seega on enaminoketoonid mittepolaarsetes lahustites 100% ulatuses cis- sisemise vesiniksidemega stabiliseeritud vorm ja polaarsetes lahustites kuni 50% transs-vormid.
noodisüsteem cis-transs on hästi kasutatav ainult isomeersete alkeenide nimetamisel, mille kaksiksideme juures on kaks erinevat tüüpi asendajat, keerulistes molekulides muutub selline nomenklatuur liiga ebamääraseks. Nendel juhtudel on välja töötatud IUPAC E,Z- tähistus, mis määratleb üheselt kõikidel võimalikel juhtudel ühendite nimetused ja on seetõttu eriti kasulik tri- ja tetraasendatud alkeenide nimetamisel. See süsteem väldib segadust selle üle, milliseid rühmi tuleks arvesse võtta. cis- või transs- üksteise suhtes.
Kui kaks vanemat rühma asuvad kaksiksideme samal küljel, see tähendab, et nad on sees cis- positsiooni üksteise suhtes, siis sellist ainet nimetatakse Z-isomeer (saksa sõnast zusammen - koos). Kui vanemad rühmad asuvad kaksiksideme vastaskülgedel (in transs-orientatsioon), siis sellist isomeeri nimetatakse E-isomeer (saksa keelest entgegen - vastand). Rühmade ja aatomite paremusjärjestus määratakse Kahn - Ingold - Prelogi reeglitega. Iga kaksiksideme kahe aatomi puhul on vaja määrata iga asendaja vanemus. Kui mõlemad vanemad asendajad asuvad π-sideme tasapinna samal küljel, tähistatakse seda konfiguratsiooni sümboliga Z, kui need rühmad asuvad π-side tasandi vastaskülgedel, siis tähistatakse konfiguratsiooni sümboliga E .
Tuleb märkida, et cis/transs ja E,Z-nomenklatuurid põhinevad seetõttu alkeenide erinevate asendajate võrdlusel Z-isomeer ei ühti alati cis-isomeer ja E-isomeer - transs-isomeer. Näiteks, transs-2-klorobuteen-2 (kaks metüülrühma C1 ja C4, buteen-2a põhiahelas on transs-orientatsioon) on ( Z)-2-klorobuteen-2 (kloor on vanem kui metüül, mis omakorda on vanem kui vesinik, seega käsitletakse kloori ja C4-metüüli koos).
cis–transs-isomeeriat leidub ka anorgaanilistes ühendites, eelkõige diaseenides ja kompleksühendites.
Diaseene (ja nendega seotud difosfeene) eksponeeritakse cis-trans- isomeeria. Nagu orgaaniliste ühendite puhul, cis-isomeer on reaktiivsem, ainult ta suudab alkeene ja alküüne alkaanideks redutseerida. Trance-isomeer, mis läheneb alkeenile, ei suuda oma vesinikuaatomeid järjestada, et alkeeni tõhusalt redutseerida, ja cis-isomeer saab selle ülesandega edukalt hakkama tänu sobivale vormile.
  |
  |
| transs- diaseen | cis- diaseen |
Oktaeedrilise või tasapinnalise ruudu geomeetriaga anorgaanilised koordinatsiooniühendid jagunevad samuti järgmisteks osadeks: cis-isomeerid, milles samad ligandid paiknevad kõrvuti, ja transs-isomeerid, milles ligandid on üksteisest eraldatud.
Näiteks Pt(NH 3) 2 Cl 2 jaoks eksisteerib kaks ruudukujulist tasapinnalist geomeetrilist isomeeri – nähtust, mida Alfred Werner selgitas 1893. aastal. cis-isomeer täisnimega cis-diklorodiamiinplaatina(II) omab kasvajavastast toimet, mida näitas Barnett Rosenberg 1969. aastal. Nüüd tuntakse seda ainet keemiaravis lühinime tsisplatiin all. Trance-isomeeril (transplatiin), vastupidi, ei oma meditsiinilist toimet. Kõiki neid isomeere saab sünteesida trans-efekti alusel, mis võimaldab saada valdavalt soovitud isomeeri.
 |
 |
|
cis- + ja transs- + |
||
Oktaeedriliste komplekside puhul valemiga MX 4 Y 2 on samuti kaks isomeeri. (Siin on M metalliaatom ning X ja Y on erinevat tüüpi ligandid.) cis-isomeer, kaks Y ligandi külgnevad üksteisega 90° nurga all, nagu on näidatud klooriaatomite puhul cis- + vasakul pildil. AT transs-isomeer näidatud paremal, kaks klooriaatomit asuvad keskmist koobaltiaatomit läbiva diagonaali vastasotstes.
Sarnast tüüpi MX 3 Y 3 oktaeedriliste komplekside isomeeria on grand os-isomeeria või näo-aksiaalne isomeeria, kui sees on teatud arv ligande cis- või transs- positsioon üksteise suhtes. AT gran- isomeerid, sama tüüpi ligandid hõivavad oktaeedri kolmnurkse külje tipud ja os-isomeerid, samad ligandid on kolmes kõrvutiasendis, nii et kaks ligandi on keskaatomi vastaskülgedel ja sellega samal teljel
Geomeetrilised isomeerid tekivad siis, kui aatomite vaba pöörlemine molekulis on kaksiksideme olemasolu tõttu piiratud. Maleiinhape (12,23) ja fumaarhape (12,24) (vastavalt cis- ja trans-) võivad olla sellise isomeeripaari näited.
Geomeetrilised isomeerid on keemilise struktuuri poolest väga sarnased, kuid nad ei ole üksteise peegelpildid ega pööra valguse polarisatsioonitasapinda. Reeglina erinevad cis- ja trans-isomeerid oluliselt füüsikaliste omaduste poolest. Näiteks maleiinhape (12,23) sulab 130°C juures, selle pKa väärtus on 1,9, see lahustub hästi külmas vees (79 g 100 ml kohta); selle geomeetrilise isomeeri - fumaarhappe (12,24) konstandid on vastavalt 287 ° C, 3,0 ja 0,7 g 100 ml kohta. Pole üllatav, et geomeetrilistel isomeeridel on erinevad bioloogilised omadused ja seetõttu on uue ühendi keemilise valemi uurimisel väga oluline võtta arvesse kõiki seda tüüpi isomeeria olemasolu võimalusi.
Cis- ja trans-isomeere saab kergesti eraldada kristallimise või kromatograafiaga. Puudub üldine meetod ühe isomeeri muundamiseks teiseks, kuid kuumutamine annab tavaliselt kõige stabiilsema isomeeri, valgusega kokkupuutumisel aga vähem stabiilsema. Inimese nägemine sõltub võrkkesta 11-cis-isomeeri muutumisest valguse toimel 11-trans-vormiks. Niipea kui põnev valgusvihk kaob,
see karotenoidpigment läheb uuesti cis-vormi, katkestades seega ajju mineva impulsi.
Tsis- ja trans-isomeerid eksisteerivad ka lamedas tsüklopentaantsüklis, mis on nagu suur kaksikside. Kuigi tsükloheksaani tsükkel ei ole üldse tasapinnaline, on see siiski piisavalt tasane, et moodustada cis- ja trans-isomeere. Seega eksisteerivad ja on saadaval nii diaminotsükloheksaani cis- (12,25) kui ka trans- (12,26) vormid. Üks ja sama molekul võib moodustada nii geomeetrilisi kui ka optilisi isomeere. Näiteks saab trans-isomeeri (12.26) eraldada (S,S) (12.27) ja (R,R) (12.28) kiraalseteks isomeerideks. Kuid cis-isomeeri ei saa jagada kiraalseteks vormideks, kuna sellel on sümmeetriatasand. Benseenitsüklil ei ole geomeetrilisi isomeere, kuna tsükli igal süsinikuaatomil on ainult üks asendaja.
1,2-diaminotsinlogensaani stereoisomeerid
Mõnikord on cis- või trans-konfiguratsiooni määramiseks keeruline kaksiksideme neljast asendajast kahte valida. Järjestusreegel näeb ette kõige raskemate aatomitega asendajate valiku, cis-vormi tähistatakse aga Z-tähega (saksa sõnast zusammen) ja teisendust tähega E (entgegen). Mõnikord tähistatakse ühendite nimetustes, milles geomeetriline isomeeria võib korduvalt avalduda, väikseima numbriga asendajat (vastavalt numeratsioonireeglile) tähega r ning tähistusi c-(cis) ja t-(trans) teiste asendajate ees näitavad nende positsiooni hr asetäitja suhtes.
Sarnaselt taimerakkude kasvu stimuleerivale indool-3-üüläädikhappele (4,82) võivad toimida ka teised karboksüülhapped, mille karboksüülrühm on aromaatse ringi tasandi suhtes nurga all. Geomeetriline isomeeria piirab kahe asendaja sellise paigutuse võimalust, seetõttu on kaneelhapetest aktiivne ainult tsisisomeer. 2-fenüültsüklopropaan-1-karboksüül- ja 1,2,3,4-tetrahüdronaftalideen-1-äädikhapetes on samuti aktiivsed ainult cis-isomeerid. Molekulaarsed mudelid näitavad, et tsükkel ja karboksüülrühm nende ainete trans-isomeeris (inaktiivses) asuvad samal tasapinnal, samas kui cis-vormis (aktiivses) ei ole need samatasandilised. Tema oli esimene, kes sellele seosele tähelepanu juhtis
mittekoplanaarsus ja Veidstra kasvu stimuleeriv tegevus. Mittetasapinnalisus võib tekkida ka steeriliste takistuste tõttu. Seega on bensoehape lameda kujuga ja ei ole aktiivne, samas kui 2,6-diklorobensoehape ja 8-metüül-1-naftoehape on mittetasapinnalised ja bioloogiliselt aktiivsed.
Auksiinide analoogides saab karboksüülrühma asendada ka teiste elektrone eemaldavate rühmadega (-CN, -NO 2 , -SO3H), kusjuures bioloogiline aktiivsus väheneb vaid veidi. Struktuuri ja tegevuse seoste kohta selles sarjas vt Koepfli, Thimann, Went (1938) ja Veidstra (1963).
Steroidide geomeetriline isomeeria väärib erilist tähelepanu. Valem (12.29) näitab selle looduslike küllastunud ühendite rühma üldist struktuuri (näidatud on süsinikuaatomite nummerdamine ja nelja tsükli tähttähised). Looduslikes steroidides on B- ja C-rõngad trans-ristmikus, mis mõlemad on ankurdatud tooli konformatsiooni. Südameglükosiidides on tsüklite C ja D ühenduskohal cis-konfiguratsioon, loomsetes hormoonides, steroolides ja sapphapetes aga trans-ühendus. Enamikus bioloogiliselt aktiivsetes steroidides on A- ja B-rõngad trans-ristmikus (rida "5a", varem nimetati "allo"). Iga steroidi molekuli rõngas moodustab voldid, mis on selgelt näha valemi (12.30) külgprojektsioonis.

Tähis "5a" näitab, et vesinikuaatom asendis 5 on tsüklite ühisest tasapinnast allpool. Kõik selle tasandi all asuvad asendajad on tähistatud sümboliga "a" ja ülal - sümboliga "p". a-asendajad on tähistatud punktiirjoonega ja ^-asendajad pidevate joontega. Sümboleid a- ja ^- kasutatakse ka teiste polütsükliliste ühendite, näiteks triterpeenide ja alkaloidide kohta. Nende ühendite struktuuri keerukus muudab R- ja S-nomenklatuuri kasutamise keeruliseks.
Reeglina on steroidühendite kõrge bioloogiline aktiivsus imetajatel seotud a-asendajate puudumisega positsioonides 1, 9, 11-13, 17 ja p-asendajate puudumisega positsioonides 4-8, 14, 15 Seda reeglit illustreerib hüdrokortisooni molekuli külgprojektsioon. Steroidhormoonide bioloogilise toime esimene samm on nende mõju valkude spetsiifilisele transpordile (jaotis 2.4). Eeldatakse, et steroidid interakteeruvad valkudega molekuli lameda põhja (a-pinna) kaudu.
Erinevad steroidid erinevad üksteisest peamiselt asendajate R1, R2 ja R3 (12,29) poolest, kuid mõnikord ka küllastamatuse astme või teiste tsüklitest väljaspool asuvate asendajate esinemise poolest. Et steroidil oleks progestiini, androgeenne ja kortikoidne aktiivsus, on reeglina vajalik tsükli A tsükloheksenoonstruktuuri olemasolu Hapnikuaatomid positsioonides 3, 11 ja 17 ning iseloomulik rühm -CO-CH 2 OH positsioonil 17. Androgeenne ja kortikoidne aktiivsus sõltub suuremal määral nendest molekuli struktuuridetailidest, kuid progestiini aktiivsus säilib, kui asendis 17 olev atsetüülrühm on a-konfiguratsioonis, mida looduslikes ühendites ei leidu, ja metüülrühma asendamine positsioonis 18 etüüliga viib isegi selle aktiivsuse suurendamiseni (suukaudne kontratseptiivne norgestreel).
Kõigist steroidhormoonidest seavad östrogeense toimega ühendid struktuurile kõige vähem ranged nõuded. Tsükli A aromatiseerimise ja 3. positsioonis happelise hüdroksüülrühma olemasolu korral on ülejäänud molekuli struktuur teisejärguline. 1938. aastal ilmusid steroidsete östrogeenide lihtsad ülitõhusad benseeni analoogid. Kuigi arvati, et nende molekulid on kujult sarnased steroidide omadega, pole tegelikult nende vahel palju ühist. Röntgendifraktsioonianalüüsi kohaselt on dietüülstilbestrooli molekulil (12.31) trans-konfiguratsioon, mis on moonutatud kahe etüülrühma metüleenfragmentide tekitatud steeriliste takistuste tõttu. Seetõttu moodustavad kaks benseenitsüklit etüleeni fragmendiga 63° kahetahulise nurga, mis muudab molekuli kuju steroidi omast täiesti erinevaks. Kuid nendes molekulides on hapnikuaatomite vaheline kaugus ligikaudu sama: 1,21 nm dietüülstilbestroolis ja 1,07–1,11 nm steroidsetes östrogeenides, kuid kõik need molekulid on liiga jäigad ega suuda seetõttu suhelda sama retseptoriga, kus ühenduspunktide vaheline kaugus on fikseeritud. On teada, et östrogeense aktiivsuse avaldumiseks on vajalik retseptori kahe vesiniksideme moodustumine ligandi hapnikuaatomitega, seetõttu peab retseptoril olema teatav paindlikkus. Oki, Urushibara (1952) märkis esimest korda, et dietüülstilbestrooli mõju on seotud ka selle molekuli paksusega, mis on 0,45 nm ja võrdub steroidsete östrogeenide molekulide paksusega.

Dietüülstilbestrool 3,4-di(4-hüdroksüfenüül)heks-3-een
(12.31), peamise naissuguhormooni östradiooli (12.32) tõhus ja odav aseaine, ilmus 1938. aastal. See sünteetiline ravim, mis erineb looduslikust hormoonist suu kaudu manustatuna kõrge efektiivsuse ja pikema toimeajaga, on saanud endokriinravi peamiseks ravimiks. Teatav umbusk selle ravimi vastu on tekkinud kahe teguri tõttu: esiteks on seda laialdaselt kasutatud põllumajandusloomade kaalu tõstmiseks ja teiseks on esinenud vähijuhtumeid naistel, kelle emad seda raseduse ajal tarvitasid. Sellest hoolimata kasutatakse dietüülstilbestrooli jätkuvalt laialdaselt ja seda peetakse ohutuks; seda ei määrata ainult raseduse esimesel kolmel kuul (mis, muide, kehtib ka loodusliku hormooni kohta). Selle fosfaadi kasutamise kohta eesnäärmevähi raviks vt jaotist. 4.2. Sarnased östrogeensed omadused on ka dietüül-stilbestrooli-sinestrooli dihüdroderivaadil (12.33, a) (konfiguratsioon 3R, 4S). See seostub östrogeeni siduva valguga (jaotis 2.4) tugevamalt kui dietüülstilbestrool ise ja selle madalam homoloog norheksestrool (12.33, b) interakteerub selle valguga veelgi tugevamalt.
Südameglükosiide käsitletakse peatükis Sec. 14.1. Steroidide keemia ja stereokeemia üksikasjalikku ülevaadet vt Shoppee (1964), biokeemia ja farmakoloogia – Briggs, Christie (1977).
4-aminokrotoonhappe geomeetrilist isomeeriat, mis aitas määrata neurotransmitteri gamma-aminovõihappe aktiivset konformatsiooni, käsitletakse peatükis. 12.7.
Konfiguratsioon sisaldab optilist ja geomeetrilist isomeeriat.
OPTILINE ISOMEERIA
1815. aastal avastas J. Biot orgaaniliste ühendite optilise aktiivsuse olemasolu. Leiti, et mõnel orgaanilisel ühendil on võime pöörata polariseeritud valguse polarisatsioonitasapinda. Aineid, millel on see võime, nimetatakse optiliselt aktiivseteks.
Kui tavavalgusvihk, milles teatavasti levivad elektromagnetilised võnked selle levimissuunaga risti erinevatel tasapindadel, lastakse läbi Nicoli prisma, siis väljuv valgus on tasapinnaline polariseeritud. elektromagnetilised võnked tekivad ainult ühel tasapinnal. Seda tasandit nimetatakse polarisatsioonitasandiks (joonis 3.2).
Kui polariseeritud valguskiir läbib optiliselt aktiivset ainet, pöördub polarisatsioonitasand teatud nurga α võrra paremale või vasakule. Kui aine kaldub polarisatsioonitasandit paremale (vaadates kiire suunas), nimetatakse seda parempoolseks, kui vasakpoolseks - vasakukäeliseks. Parempoolne pöörlemine on tähistatud märgiga (+), vasak - märgiga (-).
Riis. 3.2. Polariseeritud valguse moodustumise ja polarisatsioonitasandi pöörlemise skeem optiliselt aktiivse aine toimel
Optilist aktiivsust mõõdetakse instrumentidega, mida nimetatakse polarimeetriteks.
Optilise aktiivsuse nähtus on levinud orgaaniliste ainete, eriti looduslike (hüdroksü- ja aminohapped, valgud, süsivesikud, alkaloidid) hulgas.
Enamiku orgaaniliste ühendite optiline aktiivsus tuleneb nende struktuurist.
Üks orgaaniliste molekulide optilise aktiivsuse ilmnemise põhjusi on sp 3 -hübridiseeritud süsinikuaatomi olemasolu nende struktuuris, mis on seotud nelja erineva asendajaga. Sellist süsinikuaatomit nimetatakse kiraalseks või asümmeetriliseks. Sageli kasutatakse selle kohta üldisemat nimetust – kiraalne keskus. Struktuurivalemites tähistatakse asümmeetrilist süsinikuaatomit tavaliselt tärniga - C *:

Ühte asümmeetrilist süsinikuaatomit sisaldavad ühendid eksisteerivad kahe isomeerina, mis on üksteisega seotud peegelpildi objektina. Selliseid isomeere nimetatakse enantiomeerid.

Riis. 3.3. Bromioklorometaani enantiomeersete molekulide mudelid
Stereokeemilisi valemeid saab kasutada optiliste isomeeride ruumilise struktuuri kujutamiseks tasapinnal. Näiteks butanool-2 enantiomeerid, mis on kujutatud stereokeemiliste valemitega, on järgmised:

Samas ei ole stereokeemilised valemid alati mugavad molekulide ruumilise struktuuri kirjeldamiseks. Seetõttu on optilisi isomeere kõige sagedamini kujutatud tasapinnal, kasutades Fisheri projektsioonivalemeid. Näiteks Fischeri projektsiooni abil kujutatud 2-bromobutaani enantiomeerid näevad nii välja.

Enantiomeerid on üksteisega väga sarnased, kuid siiski mitte identsed. Neil on molekulis sama koostis ja siduvate aatomite järjestus, kuid need erinevad üksteisest oma suhtelise asukoha poolest ruumis, st konfiguratsiooni poolest. Mudeleid üksteise peale asetades on lihtne kontrollida, kas need molekulid on erinevad.
Molekulide omadust mitte olla joondatud oma peegelpildiga nimetatakse kiraalsuseks (kreeka keelest cheir - käsi) ja molekule nimetatakse ka kiraalseteks. Hea näide on vasak ja parem käsi, mis on teineteise peegelpildid, kuid samas ei saa neid kombineerida. Peegelpildiga ühilduvaid molekule nimetatakse akiraalseteks.
Molekulide kiraalsus on aine optilise aktiivsuse avaldumise eeltingimus.
Kuidas teha kindlaks, kas molekul on kiraalne? Molekuli kiraalsust saab hõlpsasti tuvastada, konstrueerides molekuli mudeli ja selle peegelpildi mudeli, millele järgneb nende superpositsioon. Kui mudelid ei ühti, on molekul kiraalne; kui need ühtivad, on see akiraalne. Sama järelduse saab teha molekulide stereokeemiliste valemite põhjal sümmeetriaelementide olemasolu või puudumise põhjal, kuna orgaaniliste ühendite optilise aktiivsuse põhjuseks on nende asümmeetriline struktuur. Kuna molekul on ruumiline moodustis, siis saab selle struktuuri vaadelda geomeetriliste kujundite sümmeetria seisukohalt. Sümmeetria peamised elemendid on tasapind, keskpunkt ja sümmeetriatelg. Kui molekulis sümmeetriatasand puudub, siis on selline molekul kiraalne.
Enantiomeeridel on samad füüsikalised ja keemilised omadused (keemistemperatuur, sulamistemperatuur, lahustuvus, elektrijuhtivus ja muud konstandid on samad), pööravad polariseeritud kiire polarisatsioonitasapinda sama nurga all, kuid on erinevusi.
Enantiomeerid erinevad pöörlemismärgi poolest, üks pöörab polariseeritud kiire polarisatsioonitasandit vasakule, teine paremale; nad reageerivad erinevatel kiirustel teiste kiraalsete ühenditega ja erinev on ka füsioloogiline toime. Näiteks ravim levomütsiin on laia toimespektriga antibiootikum. Kui selle efektiivsuseks võetakse 100, on paremale pööramise vorm vaid 2% vasakule pöörava vormi efektiivsusest.
Kui molekulis on üks asümmeetriline aatom, siis see eksisteerib kahe isomeeri kujul, aga kui molekulis on mitu asümmeetrilist süsinikuaatomit, siis võimalike isomeeride arv suureneb. Optiliste isomeeride arv määratakse järgmise valemiga:
kus N on isomeeride arv; n on asümmeetriliste süsinikuaatomite arv.
Niisiis, kui molekulis on kaks asümmeetrilist süsinikuaatomit, on isomeeride arv 2 2 \u003d 4, kolm - 2 3 \u003d 8, neli - 2 4 \u003d 16 jne.
Näiteks bromomaalhape, mis sisaldab kahte asümmeetrilist süsinikuaatomit, eksisteerib nelja stereoisomeerina (I–IV).

Stereomeerid I ja II, samuti III ja IV on omavahel seotud objekti ja selle peegelpildiga ning on enantiomeerid.
Stereoisomeerid 1 ja III, 1 ja IV, samuti II ja HI, H ja IV ei ole üksteise peegelpildid, nad erinevad konfiguratsioonilt ühe asümmeetrilise süsinikuaatomi juures. Selliseid stereoisomeere nimetatakse diastereomeerideks. Erinevalt enantiomeeridest on diastereomeeridel erinevad füüsikalised ja keemilised omadused.
Ühendite puhul, mis sisaldavad kahte kiraalset süsinikuaatomit, mis on seotud samade asendajatega, vähendatakse stereoisomeeride koguarvu kolmele. Näiteks viinhape peab eksisteerima nelja stereoisomeerina (2 2 = 4), kuid teada on ainult kolm. See on tingitud sellise elemendi esinemisest ühes stereoisomeeris sümmeetriatasandina.

Stereomeerid 1 ja II on enantiomeerid. Stereoisomeer III (mesovorm) on optiliselt inaktiivne. Mesoviinhappe molekul on akiraalne. Iga viinhappe enantiomeer on mesovormi suhtes diastereomeer.
Optiliste isomeeride nomenklatuur
Nomenklatuuris on koos ühendi nimetusega märgitud ka polariseeritud valguse tasandi konfiguratsioon ja pöörlemissuund. Viimast tähistatakse (+) märgiga paremale pöörava isomeeri või (-) märgiga vasakule pöörava isomeeri puhul.
Optiliste isomeeride konfiguratsiooni tähistamiseks on D, L- ja R,S stereokeemilised süsteemid.
D,L-konfiguratsiooni tähistussüsteem. Molekulide absoluutse konfiguratsiooni määramine on osutunud keemikute jaoks keeruliseks ülesandeks. Esimest korda sai see röntgendifraktsioonanalüüsi meetodil võimalikuks alles 1951. aastal. Kuni selle ajani määrati optiliste isomeeride konfiguratsioon võrdluseks spetsiaalselt valitud standardainega. Seda konfiguratsiooni nimetatakse suhteliseks. 1906. aastal uuris vene teadlane M.A. Rozanov pakkus suhtelise konfiguratsiooni määramise standardiks glütseraldehüüdi,

Parempoolse pöörleva isomeeri jaoks valiti Fischeri valem, milles kiraalse süsinikuaatomi hüdroksüülrühm on paremal ja vasakukäelise isomeeri puhul vasakul. Paremale pöörava isomeeri konfiguratsiooni tähistatakse tähega D ja vasakukäelise isomeeri konfiguratsiooni tähega L.
Kasutades glütseraldehüüdi võrdlusstandardina, töötati välja D,L-süsteem kiraalsete ühendite stereokeemiliseks klassifitseerimiseks, st ühendite määramiseks vastavalt D- või L-stereokeemilisse seeriasse.
D,L süsteemi kasutatakse peamiselt mitmehüdroksüülsete alkoholide, hüdroksü-, aminohapete ja süsivesikute sarjas:

Mitme asümmeetrilise süsinikuaatomiga ühendite puhul, nagu α-püroksühapped, α-aminohapped, viinhapped, määrab konfiguratsiooni tinglikult ülemine asümmeetriline süsinikuaatom (hüdroksühappe võtmega), samas kui süsivesikute molekulis on konfiguratsioon selline. (tinglikult) määratud madalama asümmeetrilise süsinikuaatomiga.

R,S-konfiguratsiooni tähistussüsteem. D,L- süsteem osutus praktiliselt vastuvõetamatuks ühendite puhul, mis glütseraldehüüdiga vähe sarnased. Seetõttu pakkusid välja R Kahn, K. Ingold ja V. Prelog R,S- süsteem optiliste isomeeride absoluutse konfiguratsiooni määramiseks. R,S- süsteem põhineb asendajate vanemuse määramisel kiraalses tsentris.
Asendajate vanemus määratakse elementide aatomnumbrite väärtuste järgi. Mida suurem on aatomnumber, seda vanem on asendaja. Näiteks bromioklorometaani molekulis väheneb asendajate vanus seerias:

Pärast asendajate vanemuse kindlakstegemist on molekuli mudel orienteeritud nii, et madalaima seerianumbriga asendaja on suunatud vaatleja silmale vastupidises suunas. Kui ülejäänud kolme asendaja vanemus väheneb päripäeva, siis on molekulil konfiguratsioon, mida tähistatakse tähega R (otlat, rectus - paremal) ja kui asendajate vanemus väheneb vastupäeva, tähistatakse konfiguratsiooni tähega S (lat . pahaendeline – vasakul). Näiteks bromioklorometaani molekuli jaoks:

Joonis 3.4. Bromioklorometaani molekuli konfiguratsiooni määramine R,S-süsteemi abil
Mõelge asendajate vanemuse ja konfiguratsiooni määratlusele keerukamate molekulide puhul, kasutades näitena piimhapet (joonis 3.4). Juba esimeses kihis (8 O, b C, 1 H, 6 C) saab selgeks, et vanem asendaja on OH rühm ja juunior vesinik. Ülejäänud kahe sama aatomnumbriga (6 C) asendaja CH^ ja COOH vanemuse määramiseks esimeses kihis on vaja arvestada teise kihiga. CH 3 rühma teise kihi aatomarvude summa \u003d 1 + 1 + 1 \u003d 3 ja COOH rühma \u003d 8 + 8 * 2 \u003d 24. See tähendab, et COOH rühm on vanem kui rühm -CH 3. väheneb reas: OH > COOH > CH 3 > H


Riis. 3.5. Piimhappe konfiguratsiooni määramine R,S-süsteemi abil
Rassikaaslased. Võrdsete koguste enantiomeeride segu on optiliselt inaktiivne ja seda nimetatakse ratseemiliseks seguks (ratsemaat). Ratsemaadid erinevad üksikutest enantiomeeridest füüsikaliste omaduste poolest, neil võib olla erinev sulamistemperatuur, lahustuvus; erinevad oma spektraalsete omaduste poolest.
Praktikas tuleb sagedamini tegeleda mitte üksikute enantiomeeridega, vaid ratsemaatidega, mis tekivad kiraalsete molekulide moodustumisel tekkivate keemiliste reaktsioonide tulemusena.
Ratsemaatide enantiomeerideks eraldamiseks kasutatakse kolme meetodit:
1. Mehaaniline meetod. Mõnede optiliselt aktiivsete ühendite kristalliseerumise tulemusena võib tekkida kaks kristallivormi, mis on objekti ja selle peegelpildina sarnased. Neid saab mikroskoobi all eraldada ettevalmistava nõelaga (mehaaniliselt).
2. Biokeemiline meetod põhineb asjaolul, et teatud tüüpi mikroorganismid eelistavad ühte enantiomeerset vormi ja söövad seda, teine jääb alles ja on kergesti eraldatav.
3. Keemiline meetod Keemiline meetod põhineb enantiomeeride muundamisel optiliselt aktiivsete reagentide abil diastereomeerideks, mis erinevad üksteisest juba füüsikaliste omaduste poolest. Diastereomeere on palju lihtsam eraldada.
Näiteks tuleks eraldada kahe happe (A + B) ratseemiline segu.Selleks lisatakse segule optiliselt aktiivne alus (C). Ratseemilise vormi ja optiliselt aktiivse aluse vaheline reaktsioon on
AC ja BC on diastereomeerid. Neil on erinev lahustuvus ja järjestikuse kristallimise meetodiga saab eraldada kaks diastereomeeri eraldi.
Kuid kuna AC ja BC moodustuvad nõrga orgaanilise happe ja alusega, kasutatakse nende lagundamiseks mineraalhappeid.

Sel viisil saadakse puhtad enantiomeerid A ja B.
GEOMEETRILINE Isomerism
Geomeetrilise isomeeria esinemise põhjuseks on vaba pöörlemise puudumine σ-sideme ümber. Seda tüüpi isomeeria on tüüpiline kaksiksidet sisaldavate ühendite ja alitsükliliste seeriate ühendite jaoks.
Geomeetrilised isomeerid on ained, millel on sama molekulvalem, sama siduvate aatomite järjestus molekulides, kuid mis erinevad üksteisest aatomite või aatomirühmade ruumilise paigutuse poolest kaksiksideme tasapinna või tsükli tasapinna suhtes. .
Seda tüüpi isomeeria tekkimise põhjuseks on tsükli moodustava kaksiksideme või σ-sidemete ümber vaba pöörlemise võimatus.
Näiteks võib buteen-2CH3-CH=CH-CH3 esineda 2 isomeeri kujul, mis erinevad metüülrühmade paigutuse poolest ruumis kaksiksideme tasapinna suhtes.

või 1,2-dimetüültsüklopropaan eksisteerib kahe isomeerina, mis erinevad metüülrühmade ruumilise paigutuse poolest tsükli tasapinna suhtes:

Geomeetriliste isomeeride konfiguratsiooni tähistamiseks kasutatakse cis-trans süsteemi. Kui samad asendajad asuvad kaksiksideme või tsükli tasapinna samal küljel, tähistatakse konfiguratsiooni cis-. kui eri külgedel - trans-.
Ühendite puhul, millel on kaksiksidemega süsinikuaatomites erinevad asendajad, kasutatakse tähistust Z,E.
Z,E-süsteem on üldisem. Seda saab kasutada mis tahes asendajate komplektiga geomeetriliste isomeeride puhul. See süsteem põhineb asendajate vanemsusel, mis määratakse iga süsinikuaatomi jaoks eraldi. Kui iga paari vanemad asendajad asuvad kaksiksideme ühel küljel, tähistatakse konfiguratsiooni tähega Z (saksa keelest zusammen - koos), kui vastaskülgedel - tähega £ (saksa keelest entgegen - vastand).
Seega on 1-bromo-1-kloropropeeni puhul võimalikud kaks isomeeri:

Ühe süsinikuaatomi vanim asendaja on metüülrühm (asendajad 1 H ja 6 CH3). ja teisel on broomiaatom (asendajad 17 Cl ja 35 Br). Isomeeris 1 asuvad vanemad asendajad kaksiksideme tasapinna ühel küljel, sellele omistatakse Z-konfiguratsioon ja isomeer II on E-konfiguratsioon (vanemad asendajad asuvad kaksiksideme tasandi vastaskülgedel).
Geomeetrilistel isomeeridel on erinevad füüsikalised omadused (sulamis- ja keemistemperatuurid, lahustuvus jne), spektriomadused ja keemilised omadused. Selline omaduste erinevus muudab nende konfiguratsiooni füüsikaliste ja keemiliste meetodite abil üsna lihtsaks.
Ligandi isomeeria
Ligandi isomeeria jaguneb sidemeks (mis on määratud sama ligandi erinevat tüüpi koordinatsiooniga) ja ligandi õigeks isomeeriaks.
Kompositsiooniga K 3 ja K 3 koobalt(III) nitro- ja nitritokomplekside olemasolu võib olla näide sideme isomeeriast, kus NO 2 - ligandi koordineerimine toimub vastavalt lämmastikuaatomi või lämmastikuaatomi kaudu. hapniku aatom. Teine näide on tiotsüanaadi iooni NCS koordineerimine lämmastiku- või väävliaatomi kaudu tiotsüanato-N- või tiotsüanato-S-komplekside moodustumisega.
Lisaks võivad komplekssed ligandid (näiteks aminohapped) ise moodustada isomeere, mille koordineerimine viib erinevate omadustega sama koostisega komplekside moodustumiseni.
geomeetriline isomeeria põhjustatud ligandide ebavõrdsest paiknemisest sisesfääris üksteise suhtes. Geomeetrilise isomeeria vajalik tingimus on vähemalt kahe erineva ligandi olemasolu sisemises koordinatsioonisfääris. Geomeetriline isomeeria avaldub peamiselt kompleksühendites, millel on oktaeedriline struktuur, lameda ruudu või ruudukujuline püramiidi struktuur.
Keerulistel tetraeedrilise, kolmnurkse ja lineaarse struktuuriga ühenditel ei ole geomeetrilisi isomeere, kuna kahte erinevat tüüpi ligandide asukohad keskaatomi ümber on samaväärsed.
Lameda ruudu struktuuriga kompleksidel võib kahe erineva ligandi L ′ ja L ′ juuresolekul olla juba kaks isomeeri (cis- ja trans-):
Cis- ja trans-isomeeridega kompleksühendi näide on diklorodiamiinplaatina(II):
Pange tähele, et lameda ruudu koostisega kompleksühendil ei saa olla isomeere: ligandi L ′′ asukoht on samatõenäoline ruudu mis tahes nurgas. Kahe erineva ligandi ilmnemisel on juba võimalik kahe erinevate omadustega isomeeri (cis- ja trans-) olemasolu. Seega on cis-diklorodiamiinplaatina (II) vees hästi lahustuvad oranžikaskollased kristallid ja trans-diklorodiamiinplaatina (II) kahvatukollased kristallid, mille lahustuvus vees on mõnevõrra madalam kui cis-isomeeril.
Kui erinevate ligandide arv sisesfääris suureneb, suureneb geomeetriliste isomeeride arv. Nitro(hüdroksüülamiin)ammiin(püridiin)plaatina(II)Cl kloriidi jaoks saadi kõik kolm isomeeri:
Oktaeedrilistel kompleksidel võib olla palju isomeere. Kui seda tüüpi kompleksühendis on kõik kuus ligandit ühesugused () või ainult üks erineb kõigist teistest (), siis ei ole ligandide üksteise suhtes erineva paigutuse võimalust. Näiteks oktaeedrilistes ühendites on ligandi L ′′ mis tahes asend ülejäänud viie ligandi L ′ suhtes samaväärne ja seetõttu ei tohiks siin olla isomeere:
Välimus kaks ligandid L′′ sisse oktaeedriline keerulised ühendid viivad olemasolu võimaluseni kaks geomeetrilist isomeeri. Sel juhul ilmneb kaks erinevat viisi ligandide L'' üksteise suhtes paigutamiseks. Näiteks dihüdroksotetraamiinkoobalt(III)+ katioonil on kaks isomeeri:
Püüdes leida mõnda muud H 3 N ja OH ligandide omavahelist paigutust, mis erineks ülaltoodutest, jõuame alati ühe juba antud struktuurini.
Kuna kompleksis suureneb erineva keemilise koostisega ligandide arv, suureneb geomeetriliste isomeeride arv kiiresti. Seda tüüpi ühenditel on neli isomeeri ja kuut erinevat ligandit sisaldavatel ühenditel kuni 15 geomeetrilist isomeeri. Sellised kompleksühendid on siiani halvasti mõistetavad.
Geomeetrilised isomeerid erinevad oluliselt füüsikalis-keemiliste omaduste poolest, nagu värvus, lahustuvus, tihedus, kristallstruktuur jne.

 I. Isomerism (kreeka sõnast isos - võrdne) Berzelius, 1830. Isomeerid on ained, millel on sama molekulvalem (sama kvalitatiivne ja kvantitatiivne koostis), kuid mis erinevad siduvate aatomite järjestuse ja (või) ruumilise paigutuse ja omavad erinevaid omadusi.
I. Isomerism (kreeka sõnast isos - võrdne) Berzelius, 1830. Isomeerid on ained, millel on sama molekulvalem (sama kvalitatiivne ja kvantitatiivne koostis), kuid mis erinevad siduvate aatomite järjestuse ja (või) ruumilise paigutuse ja omavad erinevaid omadusi.
 Berzelius, Jöns Jacob 1779 - 1848 Kuulus Rootsi keemik. Alates 1807. aastast meditsiini- ja farmaatsiaprofessor Stockholmis.
Berzelius, Jöns Jacob 1779 - 1848 Kuulus Rootsi keemik. Alates 1807. aastast meditsiini- ja farmaatsiaprofessor Stockholmis.
 C 2 H 6 O dimetüüleeter Tbp = -24 C etüülalkohol Tbp = 78 C n-butaan Tbp = -0,5 C C 4 H 10 isobutaan Tbp = -11,7 C
C 2 H 6 O dimetüüleeter Tbp = -24 C etüülalkohol Tbp = 78 C n-butaan Tbp = -0,5 C C 4 H 10 isobutaan Tbp = -11,7 C
 Isomeeride arv alkaanireas 10 butaan 2 C 14 H 30 tetradekaan 1 858 C 5 H 12 pentaan 3 C 15 H 32 pentadekaan 4 347 C 6 H 14 heksaan 5 C 20 H 42 eikosaan C hepta 7 H19 52 pentakosaan 36 797 588 C 8 H 18 oktaan 18 C 30 H 62 triakontaan 4 111 846 763 C 9 H 20 nonaan 35 C 40 H 82 tetrakontaan 62 491 518 631 801 518 381
Isomeeride arv alkaanireas 10 butaan 2 C 14 H 30 tetradekaan 1 858 C 5 H 12 pentaan 3 C 15 H 32 pentadekaan 4 347 C 6 H 14 heksaan 5 C 20 H 42 eikosaan C hepta 7 H19 52 pentakosaan 36 797 588 C 8 H 18 oktaan 18 C 30 H 62 triakontaan 4 111 846 763 C 9 H 20 nonaan 35 C 40 H 82 tetrakontaan 62 491 518 631 801 518 381
 II. Homoloogia Sama tüüpi struktuuriga ja samade funktsionaalrühmadega orgaaniliste ühendite rühmad, mis erinevad üksteisest süsinikuahelas -CH 2 - rühmade arvu poolest, moodustavad homoloogse seeria. Metaani homoloogne seeria
II. Homoloogia Sama tüüpi struktuuriga ja samade funktsionaalrühmadega orgaaniliste ühendite rühmad, mis erinevad üksteisest süsinikuahelas -CH 2 - rühmade arvu poolest, moodustavad homoloogse seeria. Metaani homoloogne seeria
 III. Isoloogiline sari. l l Need on ainete seeriad, mis on ehitatud samast arvust süsinikuaatomitest, kuid erinevad H-aatomite kvantitatiivse koostise poolest, st iga järgmine seeria liige sisaldab 2 H-aatomit vähem kui eelmine: C 2 H 6 etaan C 2 H 4 etüleen C 2 H 2 atsetüleen
III. Isoloogiline sari. l l Need on ainete seeriad, mis on ehitatud samast arvust süsinikuaatomitest, kuid erinevad H-aatomite kvantitatiivse koostise poolest, st iga järgmine seeria liige sisaldab 2 H-aatomit vähem kui eelmine: C 2 H 6 etaan C 2 H 4 etüleen C 2 H 2 atsetüleen






 Struktuurne isomeeria 3. Tautomerism (prototroopne või dünaamiline isomeeria) Tautomerism (kreeka keelest ταύτίς - sama ja μέρος - mõõt) on kahe isomeerse vormi kooseksisteerimise nähtus, mis on liikuvas tasakaalus ja on võimelised teineteisele muutuma.
Struktuurne isomeeria 3. Tautomerism (prototroopne või dünaamiline isomeeria) Tautomerism (kreeka keelest ταύτίς - sama ja μέρος - mõõt) on kahe isomeerse vormi kooseksisteerimise nähtus, mis on liikuvas tasakaalus ja on võimelised teineteisele muutuma.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="(!LANG:Konformatsioon >С ------- С Konformatsioon >С ------- С
 Geomeetriline isomeeria Geomeetrilised isomeerid - omavad molekulis samasugust sidemete järjestust (järjestust), kuid erinevad aatomite (rühmade) ruumilise paigutuse poolest kaksiksideme või väikese tsükli tasapinna suhtes.
Geomeetriline isomeeria Geomeetrilised isomeerid - omavad molekulis samasugust sidemete järjestust (järjestust), kuid erinevad aatomite (rühmade) ruumilise paigutuse poolest kaksiksideme või väikese tsükli tasapinna suhtes.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="(!LANG: Buteen-2 cis- ja trans-isomeerid Igal aatomil on >C=C cis- ja trans-isomeerid buteeni- 2 Iga aatom >C=C
 Leita Cisleitania jõge "siin ja teisel pool" - Austria krooni maade nimi; näidatud punaselt; 1867 -1918 Transleitania - Ungari krooni maade nimi; näidatud roheliselt
Leita Cisleitania jõge "siin ja teisel pool" - Austria krooni maade nimi; näidatud punaselt; 1867 -1918 Transleitania - Ungari krooni maade nimi; näidatud roheliselt




 E, Z-nomenklatuur 2 1 E-1 -nitro-1 -bromo-2 -kloropenteen 1 2 Z-1 -nitro-1 -bromo-2 -kloropenteen 1. Määrake suhteline tööstaaži Kahn-Ingold-Prelogi reeglite abil asendajatest, mis on ühendatud kaksiksidemega ja annavad neile vanemsuse numbri 1 või 2.
E, Z-nomenklatuur 2 1 E-1 -nitro-1 -bromo-2 -kloropenteen 1 2 Z-1 -nitro-1 -bromo-2 -kloropenteen 1. Määrake suhteline tööstaaži Kahn-Ingold-Prelogi reeglite abil asendajatest, mis on ühendatud kaksiksidemega ja annavad neile vanemsuse numbri 1 või 2.
 a) Suurema aatomarvuga aatom on parem kui väiksema aatomarvuga aatom. b) Kui kaks aatomit on isotoobid, siis on eelis suurema massiarvuga aatomil. 2. Kui kaks kõige kõrgemat rühma asuvad π-sideme tasandi ühel küljel, siis tähistatakse asendaja konfiguratsiooni sümboliga Z. (saksa sõnast zusammen koos) Kui need rühmad on π- vastaskülgedel. sidetasand, siis tähistatakse konfiguratsiooni sümboliga E (saksa keelest entgegen vastupidine)
a) Suurema aatomarvuga aatom on parem kui väiksema aatomarvuga aatom. b) Kui kaks aatomit on isotoobid, siis on eelis suurema massiarvuga aatomil. 2. Kui kaks kõige kõrgemat rühma asuvad π-sideme tasandi ühel küljel, siis tähistatakse asendaja konfiguratsiooni sümboliga Z. (saksa sõnast zusammen koos) Kui need rühmad on π- vastaskülgedel. sidetasand, siis tähistatakse konfiguratsiooni sümboliga E (saksa keelest entgegen vastupidine)



 Louis Pasteur (27. 12. 1822 -28. 09. 1895) Prantsuse keemik, 19. sajandi suurim uurija "Asümmeetria on see, mis eristab orgaanilist maailma anorgaanilisest" (see seadus pani aluse stereokeemiale). Asümmeetrilistel kristallidel on omadus pöörata polariseeritud valgust.
Louis Pasteur (27. 12. 1822 -28. 09. 1895) Prantsuse keemik, 19. sajandi suurim uurija "Asümmeetria on see, mis eristab orgaanilist maailma anorgaanilisest" (see seadus pani aluse stereokeemiale). Asümmeetrilistel kristallidel on omadus pöörata polariseeritud valgust.
 Enantiomeerid on ruumilised isomeerid, mille molekulid on üksteisega seotud objekti ja kokkusobimatu peegelpildina. (kreeka keelest enantios – vastand).
Enantiomeerid on ruumilised isomeerid, mille molekulid on üksteisega seotud objekti ja kokkusobimatu peegelpildina. (kreeka keelest enantios – vastand).
 Kiraalsus (inglise chirality, kreeka sõnast chéir - käsi), keemia mõiste, mis iseloomustab objekti omadust olla kokkusobimatu selle peegeldusega ideaalses tasapinnalises peeglis.
Kiraalsus (inglise chirality, kreeka sõnast chéir - käsi), keemia mõiste, mis iseloomustab objekti omadust olla kokkusobimatu selle peegeldusega ideaalses tasapinnalises peeglis.






 Fischer Emil Hermann (9. oktoober 1852 Eiskirchen – 15. juuli 1919 Berliin), saksa orgaaniline keemik ja biokeemik.
Fischer Emil Hermann (9. oktoober 1852 Eiskirchen – 15. juuli 1919 Berliin), saksa orgaaniline keemik ja biokeemik.
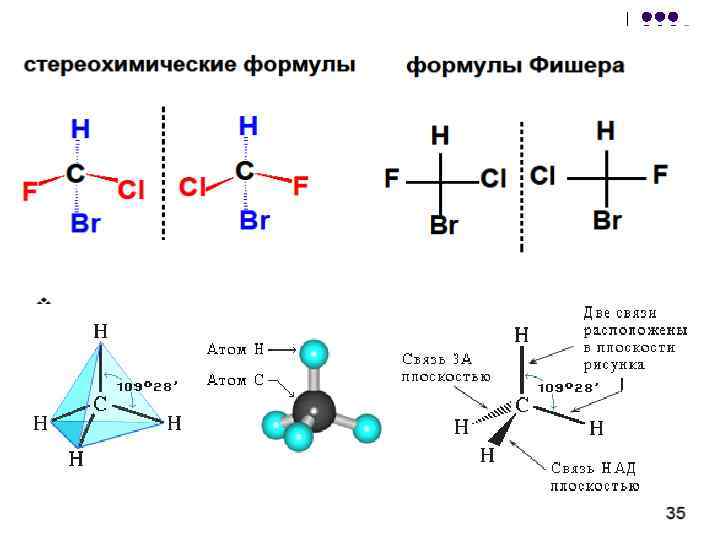


 Fisheri projektsioone saab teisendada: l l 1. paarisarv asenduspermutatsioone ei muuda valemit; 2. asendajate paaritu arv permutatsioone annab antipoodi (enantiomeeri) valemi; 3. valemit on keelatud pöörata 90 või 270 võrra, samuti valemi tuletamine sellelt tasapinnalt (need toimingud viivad antipoodi valemini); 4. kogu valemit on lubatud joonise tasapinnal pöörata 180 võrra;
Fisheri projektsioone saab teisendada: l l 1. paarisarv asenduspermutatsioone ei muuda valemit; 2. asendajate paaritu arv permutatsioone annab antipoodi (enantiomeeri) valemi; 3. valemit on keelatud pöörata 90 või 270 võrra, samuti valemi tuletamine sellelt tasapinnalt (need toimingud viivad antipoodi valemini); 4. kogu valemit on lubatud joonise tasapinnal pöörata 180 võrra;
 Suhteline konfiguratsioon 1906, M. A. Rozanovi L- ja D-isomeeride ettepanekul (ladina sõnadest laevus - vasak ja dexter - parem).
Suhteline konfiguratsioon 1906, M. A. Rozanovi L- ja D-isomeeride ettepanekul (ladina sõnadest laevus - vasak ja dexter - parem).



 Kahn-Ingold-Prelog süsteem? Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Suurbritannia) (Šveits)
Kahn-Ingold-Prelog süsteem? Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Suurbritannia) (Šveits)



 Optiliste isomeeride koguarv määratakse valemiga N = 2 n, n on kiraalsustsentrite arv. I III IV 2-amino-3-hüdroksübutaanhape
Optiliste isomeeride koguarv määratakse valemiga N = 2 n, n on kiraalsustsentrite arv. I III IV 2-amino-3-hüdroksübutaanhape
 Viinhape I III IV erütrotreo Epimeerid on diastereomeerid, mis erinevad ainult ühe asümmeetrilise tsentri konfiguratsiooni poolest
Viinhape I III IV erütrotreo Epimeerid on diastereomeerid, mis erinevad ainult ühe asümmeetrilise tsentri konfiguratsiooni poolest

 Racemate (ladina keelest racemus - viinamarjad). D - ja L - stereoisomeeride ekvimolaarsetes kogustes segamisel tekivad optiliselt inaktiivsed segud, mida nimetatakse ratseemilisteks S (lad. sinister - vasak) ja R (lat. rectus - parem); Ratsemaati tähistatakse sümboliga RS. Ratseemiliste segude tükeldamine: 1. Mehaaniline meetod (Pasteuri meetod). 2. Mikrobioloogiline meetod 3. Ensümaatiline meetod. 4. Keemiline meetod. afiinsuskromatograafia
Racemate (ladina keelest racemus - viinamarjad). D - ja L - stereoisomeeride ekvimolaarsetes kogustes segamisel tekivad optiliselt inaktiivsed segud, mida nimetatakse ratseemilisteks S (lad. sinister - vasak) ja R (lat. rectus - parem); Ratsemaati tähistatakse sümboliga RS. Ratseemiliste segude tükeldamine: 1. Mehaaniline meetod (Pasteuri meetod). 2. Mikrobioloogiline meetod 3. Ensümaatiline meetod. 4. Keemiline meetod. afiinsuskromatograafia
 STEREOKEEMILISE STRUKTUURI VASTASTIKULE SEOTUD BIOLOOGILISE AKTIIVSUSE AVALDUMISEGA. Adrenaliin, epinefriin IUPAC: 1 - (3, 4 -dihüdroksüfenüül) -2 metüülaminoetanool - loomade ja inimeste neerupealise säsi hormoon. Külmavereliste loomade närvisüsteemi vahendaja. Kahest adrenaliini enantiomeerist on R (-) adrenaliinil kõrgeim farmakoloogiline aktiivsus.
STEREOKEEMILISE STRUKTUURI VASTASTIKULE SEOTUD BIOLOOGILISE AKTIIVSUSE AVALDUMISEGA. Adrenaliin, epinefriin IUPAC: 1 - (3, 4 -dihüdroksüfenüül) -2 metüülaminoetanool - loomade ja inimeste neerupealise säsi hormoon. Külmavereliste loomade närvisüsteemi vahendaja. Kahest adrenaliini enantiomeerist on R (-) adrenaliinil kõrgeim farmakoloogiline aktiivsus.

 STEREOKEEMILISE STRUKTUURI VASTASTIKULE SEOTUD BIOLOOGILISE AKTIIVSUSE AVALDUMISEGA. Paremale pöörav isopropüradrenaliin (Isadrine) on 800 korda rohkem bronhe laiendav kui selle vasakule pöörav enantiomeer.
STEREOKEEMILISE STRUKTUURI VASTASTIKULE SEOTUD BIOLOOGILISE AKTIIVSUSE AVALDUMISEGA. Paremale pöörav isopropüradrenaliin (Isadrine) on 800 korda rohkem bronhe laiendav kui selle vasakule pöörav enantiomeer.

 Diastereomeerid on ruumilised isomeerid, mille molekulid EI suhestu üksteisega objekti ja kokkusobimatu peegelpildina.
Diastereomeerid on ruumilised isomeerid, mille molekulid EI suhestu üksteisega objekti ja kokkusobimatu peegelpildina.

 Konformatsiooniline isomeeria Konformatsiooniline isomeeria tekib sama molekuli osade erineva paigutuse tulemusena üksteise suhtes, mis saavutatakse nende osade pööramisel ümber kahte aatomit ühendava lihtsa C-C sideme.
Konformatsiooniline isomeeria Konformatsiooniline isomeeria tekib sama molekuli osade erineva paigutuse tulemusena üksteise suhtes, mis saavutatakse nende osade pööramisel ümber kahte aatomit ühendava lihtsa C-C sideme.
 (lat. conformatio - kujund, paigutus), erinevad ruumilised vormid, mille molekulid võtavad üksikute fragmentide vaba pöörlemise tulemusena lihtsate C-C sidemete ümber.
(lat. conformatio - kujund, paigutus), erinevad ruumilised vormid, mille molekulid võtavad üksikute fragmentide vaba pöörlemise tulemusena lihtsate C-C sidemete ümber.







 69% 31% Van der Waalsi pinge – valentsivabade suurte asendajate vahelise tõukejõu tõttu.
69% 31% Van der Waalsi pinge – valentsivabade suurte asendajate vahelise tõukejõu tõttu.