

 I. Isomerism (kreeka sõnast isos - võrdne) Berzelius, 1830. Isomeerid on ained, millel on sama molekulvalem (sama kvalitatiivne ja kvantitatiivne koostis), kuid mis erinevad siduvate aatomite järjestuse ja (või) ruumilise paigutuse ja omavad erinevaid omadusi.
I. Isomerism (kreeka sõnast isos - võrdne) Berzelius, 1830. Isomeerid on ained, millel on sama molekulvalem (sama kvalitatiivne ja kvantitatiivne koostis), kuid mis erinevad siduvate aatomite järjestuse ja (või) ruumilise paigutuse ja omavad erinevaid omadusi.
 Berzelius, Jöns Jacob 1779 - 1848 Kuulus Rootsi keemik. Alates 1807. aastast meditsiini- ja farmaatsiaprofessor Stockholmis.
Berzelius, Jöns Jacob 1779 - 1848 Kuulus Rootsi keemik. Alates 1807. aastast meditsiini- ja farmaatsiaprofessor Stockholmis.
 C 2 H 6 O dimetüüleeter Tbp = -24 C etüülalkohol Tbp = 78 C n-butaan Tbp = -0,5 C C 4 H 10 isobutaan Tbp = -11,7 C
C 2 H 6 O dimetüüleeter Tbp = -24 C etüülalkohol Tbp = 78 C n-butaan Tbp = -0,5 C C 4 H 10 isobutaan Tbp = -11,7 C
 Isomeeride arv alkaanireas 10 butaan 2 C 14 H 30 tetradekaan 1 858 C 5 H 12 pentaan 3 C 15 H 32 pentadekaan 4 347 C 6 H 14 heksaan 5 C 20 H 42 eikosaan C hepta H196 C hepta 7 H19 52 pentakosaan 36 797 588 C 8 H 18 oktaan 18 C 30 H 62 triakontaan 4 111 846 763 C 9 H 20 nonaan 35 C 40 H 82 tetrakontaan 62 491 518 631 801 518 381
Isomeeride arv alkaanireas 10 butaan 2 C 14 H 30 tetradekaan 1 858 C 5 H 12 pentaan 3 C 15 H 32 pentadekaan 4 347 C 6 H 14 heksaan 5 C 20 H 42 eikosaan C hepta H196 C hepta 7 H19 52 pentakosaan 36 797 588 C 8 H 18 oktaan 18 C 30 H 62 triakontaan 4 111 846 763 C 9 H 20 nonaan 35 C 40 H 82 tetrakontaan 62 491 518 631 801 518 381
 II. Homoloogia Sama tüüpi struktuuriga ja samade funktsionaalrühmadega orgaaniliste ühendite rühmad, mis erinevad üksteisest süsinikuahelas -CH 2 - rühmade arvu poolest, moodustavad homoloogse seeria. Metaani homoloogne seeria
II. Homoloogia Sama tüüpi struktuuriga ja samade funktsionaalrühmadega orgaaniliste ühendite rühmad, mis erinevad üksteisest süsinikuahelas -CH 2 - rühmade arvu poolest, moodustavad homoloogse seeria. Metaani homoloogne seeria
 III. Isoloogilised jooned. l l Need on ainete seeriad, mis on ehitatud samast arvust süsinikuaatomitest, kuid erinevad H-aatomite kvantitatiivse koostise poolest, st iga järgmine seeria liige sisaldab 2 H-aatomit vähem kui eelmine: C 2 H 6 etaan C 2 H 4 etüleen C 2 H 2 atsetüleen
III. Isoloogilised jooned. l l Need on ainete seeriad, mis on ehitatud samast arvust süsinikuaatomitest, kuid erinevad H-aatomite kvantitatiivse koostise poolest, st iga järgmine seeria liige sisaldab 2 H-aatomit vähem kui eelmine: C 2 H 6 etaan C 2 H 4 etüleen C 2 H 2 atsetüleen






 Struktuurne isomeeria 3. Tautomerism (prototroopne või dünaamiline isomeeria) Tautomerism (kreeka keelest ταύτίς - sama ja μέρος - mõõt) on kahe isomeerse vormi kooseksisteerimise nähtus, mis on liikuvas tasakaalus ja on võimelised teineteisele muutuma.
Struktuurne isomeeria 3. Tautomerism (prototroopne või dünaamiline isomeeria) Tautomerism (kreeka keelest ταύτίς - sama ja μέρος - mõõt) on kahe isomeerse vormi kooseksisteerimise nähtus, mis on liikuvas tasakaalus ja on võimelised teineteisele muutuma.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="(!LANG:Konformatsioon >С ------- С Konformatsioon >С ------- С
 Geomeetriline isomeeria Geomeetrilised isomeerid - omavad molekulis samasugust sidemete järjestust (järjestust), kuid erinevad aatomite (rühmade) ruumilise paigutuse poolest kaksiksideme või väikese tsükli tasapinna suhtes.
Geomeetriline isomeeria Geomeetrilised isomeerid - omavad molekulis samasugust sidemete järjestust (järjestust), kuid erinevad aatomite (rühmade) ruumilise paigutuse poolest kaksiksideme või väikese tsükli tasapinna suhtes.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="(!LANG: buteen-2 cis- ja trans-isomeerid Igal aatomil on >C=C cis- ja trans-isomeerid buteeni- 2 Iga aatom >C=C
 Leita Cisleitania jõge "siin ja teisel pool" - Austria krooni maade nimi; näidatud punaselt; 1867 -1918 Transleitania - Ungari krooni maade nimi; näidatud roheliselt
Leita Cisleitania jõge "siin ja teisel pool" - Austria krooni maade nimi; näidatud punaselt; 1867 -1918 Transleitania - Ungari krooni maade nimi; näidatud roheliselt




 E, Z-nomenklatuur 2 1 E-1 -nitro-1 -bromo-2 -kloropenteen 1 2 Z-1 -nitro-1 -bromo-2 -kloropenteen 1. Määrake suhteline tööstaaži Kahn-Ingold-Prelogi reeglite abil asendajatest, mis on ühendatud kaksiksidemega ja annavad neile vanemsuse numbri 1 või 2.
E, Z-nomenklatuur 2 1 E-1 -nitro-1 -bromo-2 -kloropenteen 1 2 Z-1 -nitro-1 -bromo-2 -kloropenteen 1. Määrake suhteline tööstaaži Kahn-Ingold-Prelogi reeglite abil asendajatest, mis on ühendatud kaksiksidemega ja annavad neile vanemsuse numbri 1 või 2.
 a) Suurema aatomarvuga aatom on parem kui väiksema aatomarvuga aatom. b) Kui kaks aatomit on isotoobid, siis on eelis suurema massiarvuga aatomil. 2. Kui kaks kõige kõrgemat rühma asuvad π-sideme tasandi ühel küljel, siis tähistatakse asendaja konfiguratsiooni sümboliga Z. (saksa keelest zusammen koos) Kui need rühmad on π- vastaskülgedel. sidetasand, siis tähistatakse konfiguratsiooni sümboliga E (saksa keelest entgegen vastupidine)
a) Suurema aatomarvuga aatom on parem kui väiksema aatomarvuga aatom. b) Kui kaks aatomit on isotoobid, siis on eelis suurema massiarvuga aatomil. 2. Kui kaks kõige kõrgemat rühma asuvad π-sideme tasandi ühel küljel, siis tähistatakse asendaja konfiguratsiooni sümboliga Z. (saksa keelest zusammen koos) Kui need rühmad on π- vastaskülgedel. sidetasand, siis tähistatakse konfiguratsiooni sümboliga E (saksa keelest entgegen vastupidine)



 Louis Pasteur (27. 12. 1822 -28. 09. 1895) Prantsuse keemik, 19. sajandi suurim uurija "Asümmeetria on see, mis eristab orgaanilist maailma anorgaanilisest" (see seadus pani aluse stereokeemiale). Asümmeetrilistel kristallidel on omadus pöörata polariseeritud valgust.
Louis Pasteur (27. 12. 1822 -28. 09. 1895) Prantsuse keemik, 19. sajandi suurim uurija "Asümmeetria on see, mis eristab orgaanilist maailma anorgaanilisest" (see seadus pani aluse stereokeemiale). Asümmeetrilistel kristallidel on omadus pöörata polariseeritud valgust.
 Enantiomeerid on ruumilised isomeerid, mille molekulid on üksteisega seotud objekti ja kokkusobimatu peegelpildina. (kreeka keelest enantios – vastand).
Enantiomeerid on ruumilised isomeerid, mille molekulid on üksteisega seotud objekti ja kokkusobimatu peegelpildina. (kreeka keelest enantios – vastand).
 Kiraalsus (inglise chirality, kreeka sõnast chéir – käsi), keemia mõiste, mis iseloomustab objekti omadust olla kokkusobimatu selle peegeldusega ideaalses lamepeeglis.
Kiraalsus (inglise chirality, kreeka sõnast chéir – käsi), keemia mõiste, mis iseloomustab objekti omadust olla kokkusobimatu selle peegeldusega ideaalses lamepeeglis.






 Fischer Emil Hermann (9. oktoober 1852 Eiskirchen – 15. juuli 1919 Berliin), saksa orgaaniline keemik ja biokeemik.
Fischer Emil Hermann (9. oktoober 1852 Eiskirchen – 15. juuli 1919 Berliin), saksa orgaaniline keemik ja biokeemik.


 Fisheri projektsioone saab teisendada: l l 1. paarisarv asenduspermutatsioone ei muuda valemit; 2. asendajate paaritu arv permutatsioone annab antipoodi (enantiomeeri) valemi; 3. valemit on keelatud pöörata 90 või 270 võrra, samuti valemi tuletamine sellelt tasapinnalt (need toimingud viivad antipoodi valemini); 4. kogu valemit on lubatud joonise tasapinnal pöörata 180 võrra;
Fisheri projektsioone saab teisendada: l l 1. paarisarv asenduspermutatsioone ei muuda valemit; 2. asendajate paaritu arv permutatsioone annab antipoodi (enantiomeeri) valemi; 3. valemit on keelatud pöörata 90 või 270 võrra, samuti valemi tuletamine sellelt tasapinnalt (need toimingud viivad antipoodi valemini); 4. kogu valemit on lubatud joonise tasapinnal pöörata 180 võrra;
 Suhteline konfiguratsioon 1906, M. A. Rozanovi L- ja D-isomeeride ettepanekul (ladina sõnadest laevus - vasak ja dexter - parem).
Suhteline konfiguratsioon 1906, M. A. Rozanovi L- ja D-isomeeride ettepanekul (ladina sõnadest laevus - vasak ja dexter - parem).



 Kahn-Ingold-Prelog süsteem? Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Suurbritannia) (Šveits)
Kahn-Ingold-Prelog süsteem? Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Suurbritannia) (Šveits)



 Optiliste isomeeride koguarv määratakse valemiga N = 2 n, n on kiraalsustsentrite arv. I III IV 2-amino-3-hüdroksübutaanhape
Optiliste isomeeride koguarv määratakse valemiga N = 2 n, n on kiraalsustsentrite arv. I III IV 2-amino-3-hüdroksübutaanhape
 Viinhape I III IV erütrotreo Epimeerid on diastereomeerid, mis erinevad ainult ühe asümmeetrilise tsentri konfiguratsiooni poolest
Viinhape I III IV erütrotreo Epimeerid on diastereomeerid, mis erinevad ainult ühe asümmeetrilise tsentri konfiguratsiooni poolest

 Racemate (ladina keelest racemus - viinamarjad). Ekvimolaarsetes kogustes D - ja L - stereoisomeeride segamisel tekivad optiliselt inaktiivsed segud, mida nimetatakse ratseemilisteks S-deks (lat. sinister - vasak) ja R (lat. rectus - parem); Ratsemaati tähistatakse sümboliga RS. Ratseemiliste segude tükeldamine: 1. Mehaaniline meetod (Pasteuri meetod). 2. Mikrobioloogiline meetod 3. Ensümaatiline meetod. 4. Keemiline meetod. afiinsuskromatograafia
Racemate (ladina keelest racemus - viinamarjad). Ekvimolaarsetes kogustes D - ja L - stereoisomeeride segamisel tekivad optiliselt inaktiivsed segud, mida nimetatakse ratseemilisteks S-deks (lat. sinister - vasak) ja R (lat. rectus - parem); Ratsemaati tähistatakse sümboliga RS. Ratseemiliste segude tükeldamine: 1. Mehaaniline meetod (Pasteuri meetod). 2. Mikrobioloogiline meetod 3. Ensümaatiline meetod. 4. Keemiline meetod. afiinsuskromatograafia
 STEREOKEEMILISE STRUKTUURI VASTASTIKULE SEOTUD BIOLOOGILISE AKTIIVSUSE AVALDUMISEGA. Adrenaliin, epinefriin IUPAC: 1 - (3, 4 -dihüdroksüfenüül) -2 metüülaminoetanool - loomade ja inimeste neerupealise säsi hormoon. Külmavereliste loomade närvisüsteemi vahendaja. Kahest adrenaliini enantiomeerist on R (-) adrenaliinil kõrgeim farmakoloogiline aktiivsus.
STEREOKEEMILISE STRUKTUURI VASTASTIKULE SEOTUD BIOLOOGILISE AKTIIVSUSE AVALDUMISEGA. Adrenaliin, epinefriin IUPAC: 1 - (3, 4 -dihüdroksüfenüül) -2 metüülaminoetanool - loomade ja inimeste neerupealise säsi hormoon. Külmavereliste loomade närvisüsteemi vahendaja. Kahest adrenaliini enantiomeerist on R (-) adrenaliinil kõrgeim farmakoloogiline aktiivsus.

 STEREOKEEMILISE STRUKTUURI VASTASTIKULE SEOTUD BIOLOOGILISE AKTIIVSUSE AVALDUMISEGA. Paremale pöörav isopropüradrenaliin (Isadrine) on 800 korda rohkem bronhe laiendav kui selle vasakule pöörav enantiomeer.
STEREOKEEMILISE STRUKTUURI VASTASTIKULE SEOTUD BIOLOOGILISE AKTIIVSUSE AVALDUMISEGA. Paremale pöörav isopropüradrenaliin (Isadrine) on 800 korda rohkem bronhe laiendav kui selle vasakule pöörav enantiomeer.

 Diastereomeerid on ruumilised isomeerid, mille molekulid EI suhestu üksteisega objekti ja kokkusobimatu peegelpildina.
Diastereomeerid on ruumilised isomeerid, mille molekulid EI suhestu üksteisega objekti ja kokkusobimatu peegelpildina.

 Konformatsiooniline isomeeria Konformatsiooniline isomeeria tekib sama molekuli osade erineva paigutuse tulemusena üksteise suhtes, mis saavutatakse nende osade pööramisel ümber kahte aatomit ühendava lihtsa C-C sideme.
Konformatsiooniline isomeeria Konformatsiooniline isomeeria tekib sama molekuli osade erineva paigutuse tulemusena üksteise suhtes, mis saavutatakse nende osade pööramisel ümber kahte aatomit ühendava lihtsa C-C sideme.
 (lat. conformatio - kuju, paigutus), erinevad ruumivormid, mis on võetud molekulide poolt üksikute fragmentide vaba pöörlemise tulemusena lihtsate C-C sidemete ümber.
(lat. conformatio - kuju, paigutus), erinevad ruumivormid, mis on võetud molekulide poolt üksikute fragmentide vaba pöörlemise tulemusena lihtsate C-C sidemete ümber.







 69% 31% Van der Waalsi pinge – valentsivabade suurte asendajate vahelise tõukejõu tõttu.
69% 31% Van der Waalsi pinge – valentsivabade suurte asendajate vahelise tõukejõu tõttu.
Tunni jooksul saate üldise ettekujutuse isomeeria tüüpidest, saate teada, mis on isomeer. Õppige tundma orgaanilise keemia isomeeria liike: struktuurne ja ruumiline (stereoisomeeria). Ainete struktuurivalemeid kasutades kaaluge struktuurse isomeeria alamliike (skeleti- ja asendiisomeeria), tutvuge ruumilise isomeeria eri liikidega: geomeetriline ja optiline.
Teema: Sissejuhatus orgaanilisse keemiasse
Õppetund: Isomerism. Isomerismi tüübid. Struktuurne isomeeria, geomeetriline, optiline
Valemite tüübid, mida me varem käsitlesime ja mis kirjeldavad orgaanilisi aineid, näitavad, et ühele molekulaarvalemile võib vastata mitu erinevat struktuurivalemit.
Näiteks molekulaarvalem C2H6O vastama kaks ainet erinevate struktuurivalemitega - etüülalkohol ja dimetüüleeter. Riis. üks.
Etüülalkohol, vedelik, mis reageerib metallilise naatriumiga vesiniku vabanemiseks, keeb temperatuuril +78,5 0 C. Samadel tingimustel keeb -23 0 C juures naatriumiga mittereageeriv gaas dimetüüleeter.
Need ained erinevad oma struktuuri poolest – erinevad ained vastavad samale molekulvalemile.
Riis. 1. Klassidevaheline isomeeria
Sama koostisega, kuid erineva struktuuriga ja seetõttu ka erinevate omadustega ainete olemasolu nähtust nimetatakse isomeeriks (kreeka sõnadest "isos" - "võrdne" ja "meros" - "osa", "osake").
Isomerismi tüübid
Isomeeriat on erinevat tüüpi.
Struktuurne isomeeria on seotud molekuli aatomite erineva ühendusjärjekorraga.
Etanool ja dimetüüleeter on struktuursed isomeerid. Kuna need kuuluvad erinevatesse orgaaniliste ühendite klassidesse, nimetatakse seda tüüpi struktuuriisomeeriaks ka klassidevaheline . Riis. üks.
Struktuursed isomeerid võivad samuti kuuluda samasse ühendite klassi, näiteks vastab valem C5H12 kolmele erinevale süsivesinikule. seda süsiniku skeleti isomeeria. Riis. 2.

Riis. 2 Ainenäited – struktuuriisomeerid
On olemas sama süsiniku karkassiga struktuursed isomeerid, mis erinevad mitme sideme (kaksik- ja kolmiksideme) või vesinikku asendavate aatomite asukoha poolest. Sellist struktuuriisomeeriat nimetatakse asendi isomeeria.
Riis. 3. Struktuurne asendiisomeeria
Ainult üksiksidemeid sisaldavates molekulides on toatemperatuuril võimalik molekuli fragmentide peaaegu vaba pöörlemine sidemete ümber ja näiteks kõik 1,2-dikloroetaani valemite kujutised on samaväärsed. Riis. neli

Riis. 4. Kloori aatomite asend üksiksideme ümber
Kui pöörlemine on raskendatud näiteks tsüklilises molekulis või kaksiksidemega, siis geomeetriline või cis-trans isomeeria. Cis-isomeerides on asendajad tsükli tasapinnal või kaksiksidemes samal küljel, trans-isomeerides on need vastaskülgedel.
Cis-trans isomeerid eksisteerivad siis, kui kaks erinevat asetäitja. Riis. 5.



Riis. 5. Cis- ja trans-isomeerid
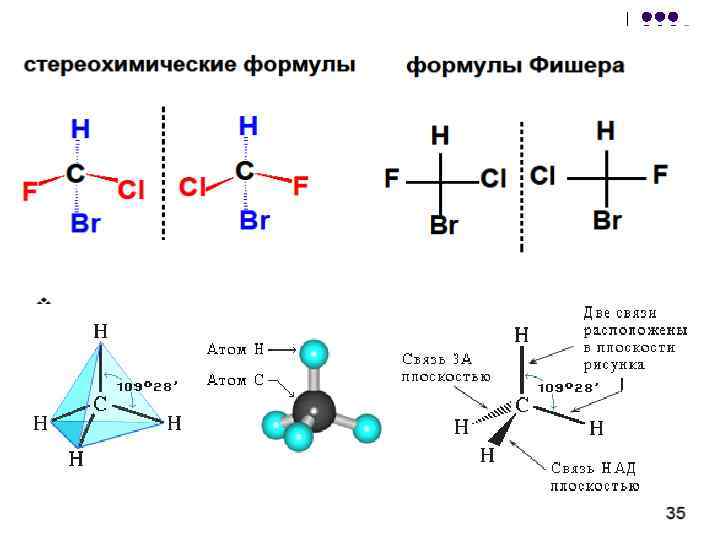
Teist tüüpi isomeeria tuleneb asjaolust, et nelja üksiksidemega süsinikuaatom moodustab koos oma asendajatega ruumilise struktuuri - tetraeedri. Kui molekulis on vähemalt üks süsinikuaatom, mis on seotud nelja erineva asendajaga, optiline isomeeria. Sellised molekulid ei lange kokku nende peegelpildiga. Seda omadust nimetatakse kiraalsuseks – kreeka keelest Koossiia- "käsi". Riis. 6. Optiline isomeeria on iseloomulik paljudele elusorganisme moodustavatele molekulidele.
|
|
|
Riis. 6. Optiliste isomeeride näited
Optilist isomeeriat nimetatakse ka enantiomeerid (kreeka keelest enantios- "vastupidine" ja meros- "osa") ja optilised isomeerid - enantiomeerid . Enantiomeerid on optiliselt aktiivsed, nad pööravad valguse polarisatsioonitasandit sama nurga all, kuid vastupidises suunas: d- , või (+)-isomeer, - paremale, l- , või (-)-isomeer, - vasakule. Võrdsete koguste enantiomeeride segu nimetatakse ratsemaat, on optiliselt passiivne ja seda tähistatakse sümboliga d,l- või (±).
Õppetunni kokkuvõte
Tunni jooksul saite üldise ettekujutuse isomeeria tüüpidest, mis on isomeer. Õppis tundma isomeeria liike orgaanilises keemias: struktuurne ja ruumiline (stereoisomeeria). Ainete struktuurivalemite abil vaatlesime struktuurse isomeeria alamliike (skeleti- ja asendiisomeeria), tutvusime ruumilise isomeeria eri liikidega: geomeetriline ja optiline.
Bibliograafia
1. Rudzitis G.E. Keemia. Üldkeemia alused. 10. klass: õpik õppeasutustele: algtase / G. E. Rudzitis, F.G. Feldman. - 14. trükk. - M.: Haridus, 2012.
2. Keemia. 10. klass. Profiili tase: õpik. üldhariduse jaoks institutsioonid / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin ja teised - M.: Drofa, 2008. - 463 lk.
3. Keemia. 11. klass. Profiili tase: õpik. üldhariduse jaoks institutsioonid / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin ja teised - M.: Drofa, 2010. - 462 lk.
4. Khomchenko G.P., Khomchenko I.G. Keemiaülesannete kogu ülikoolidesse astujatele. - 4. väljaanne - M.: RIA "Uus laine": Kirjastus Umerenkov, 2012. - 278 lk.
Kodutöö
1. Nr 1,2 (lk 39) Rudzitis G.E. Keemia. Üldkeemia alused. 10. klass: õpik õppeasutustele: algtase / G. E. Rudzitis, F.G. Feldman. - 14. trükk. - M.: Haridus, 2012.
2. Miks on etüleeni seeria süsivesinikes isomeeride arv suurem kui küllastunud süsivesinikes?
3. Millistel süsivesinikel on ruumilised isomeerid?
Tunni jooksul saate üldise ettekujutuse isomeeria tüüpidest, saate teada, mis on isomeer. Õppige tundma orgaanilise keemia isomeeria liike: struktuurne ja ruumiline (stereoisomeeria). Ainete struktuurivalemeid kasutades kaaluge struktuurse isomeeria alamliike (skeleti- ja asendiisomeeria), tutvuge ruumilise isomeeria eri liikidega: geomeetriline ja optiline.
Teema: Sissejuhatus orgaanilisse keemiasse
Õppetund: Isomerism. Isomerismi tüübid. Struktuurne isomeeria, geomeetriline, optiline
Valemite tüübid, mida me varem käsitlesime ja mis kirjeldavad orgaanilisi aineid, näitavad, et ühele molekulaarvalemile võib vastata mitu erinevat struktuurivalemit.
Näiteks molekulaarvalem C2H6O vastama kaks ainet erinevate struktuurivalemitega - etüülalkohol ja dimetüüleeter. Riis. üks.
Etüülalkohol, vedelik, mis reageerib metallilise naatriumiga vesiniku vabanemiseks, keeb temperatuuril +78,5 0 C. Samadel tingimustel keeb -23 0 C juures naatriumiga mittereageeriv gaas dimetüüleeter.
Need ained erinevad oma struktuuri poolest – erinevad ained vastavad samale molekulvalemile.
Riis. 1. Klassidevaheline isomeeria
Sama koostisega, kuid erineva struktuuriga ja seetõttu ka erinevate omadustega ainete olemasolu nähtust nimetatakse isomeeriks (kreeka sõnadest "isos" - "võrdne" ja "meros" - "osa", "osake").
Isomerismi tüübid
Isomeeriat on erinevat tüüpi.
Struktuurne isomeeria on seotud molekuli aatomite erineva ühendusjärjekorraga.
Etanool ja dimetüüleeter on struktuursed isomeerid. Kuna need kuuluvad erinevatesse orgaaniliste ühendite klassidesse, nimetatakse seda tüüpi struktuuriisomeeriaks ka klassidevaheline . Riis. üks.
Struktuursed isomeerid võivad samuti kuuluda samasse ühendite klassi, näiteks vastab valem C5H12 kolmele erinevale süsivesinikule. seda süsiniku skeleti isomeeria. Riis. 2.

Riis. 2 Ainenäited – struktuuriisomeerid
On olemas sama süsiniku karkassiga struktuursed isomeerid, mis erinevad mitme sideme (kaksik- ja kolmiksideme) või vesinikku asendavate aatomite asukoha poolest. Sellist struktuuriisomeeriat nimetatakse asendi isomeeria.
Riis. 3. Struktuurne asendiisomeeria
Ainult üksiksidemeid sisaldavates molekulides on toatemperatuuril võimalik molekuli fragmentide peaaegu vaba pöörlemine sidemete ümber ja näiteks kõik 1,2-dikloroetaani valemite kujutised on samaväärsed. Riis. neli

Riis. 4. Kloori aatomite asend üksiksideme ümber
Kui pöörlemine on raskendatud näiteks tsüklilises molekulis või kaksiksidemega, siis geomeetriline või cis-trans isomeeria. Cis-isomeerides on asendajad tsükli tasapinnal või kaksiksidemes samal küljel, trans-isomeerides on need vastaskülgedel.
Cis-trans isomeerid eksisteerivad siis, kui kaks erinevat asetäitja. Riis. 5.



Riis. 5. Cis- ja trans-isomeerid
Teist tüüpi isomeeria tuleneb asjaolust, et nelja üksiksidemega süsinikuaatom moodustab koos oma asendajatega ruumilise struktuuri - tetraeedri. Kui molekulis on vähemalt üks süsinikuaatom, mis on seotud nelja erineva asendajaga, optiline isomeeria. Sellised molekulid ei lange kokku nende peegelpildiga. Seda omadust nimetatakse kiraalsuseks – kreeka keelest Koossiia- "käsi". Riis. 6. Optiline isomeeria on iseloomulik paljudele elusorganisme moodustavatele molekulidele.
|
|
|
Riis. 6. Optiliste isomeeride näited
Optilist isomeeriat nimetatakse ka enantiomeerid (kreeka keelest enantios- "vastupidine" ja meros- "osa") ja optilised isomeerid - enantiomeerid . Enantiomeerid on optiliselt aktiivsed, nad pööravad valguse polarisatsioonitasandit sama nurga all, kuid vastupidises suunas: d- , või (+)-isomeer, - paremale, l- , või (-)-isomeer, - vasakule. Võrdsete koguste enantiomeeride segu nimetatakse ratsemaat, on optiliselt passiivne ja seda tähistatakse sümboliga d,l- või (±).
Õppetunni kokkuvõte
Tunni jooksul saite üldise ettekujutuse isomeeria tüüpidest, mis on isomeer. Õppis tundma isomeeria liike orgaanilises keemias: struktuurne ja ruumiline (stereoisomeeria). Ainete struktuurivalemite abil vaatlesime struktuurse isomeeria alamliike (skeleti- ja asendiisomeeria), tutvusime ruumilise isomeeria eri liikidega: geomeetriline ja optiline.
Bibliograafia
1. Rudzitis G.E. Keemia. Üldkeemia alused. 10. klass: õpik õppeasutustele: algtase / G. E. Rudzitis, F.G. Feldman. - 14. trükk. - M.: Haridus, 2012.
2. Keemia. 10. klass. Profiili tase: õpik. üldhariduse jaoks institutsioonid / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin ja teised - M.: Drofa, 2008. - 463 lk.
3. Keemia. 11. klass. Profiili tase: õpik. üldhariduse jaoks institutsioonid / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin ja teised - M.: Drofa, 2010. - 462 lk.
4. Khomchenko G.P., Khomchenko I.G. Keemiaülesannete kogu ülikoolidesse astujatele. - 4. väljaanne - M.: RIA "Uus laine": Kirjastus Umerenkov, 2012. - 278 lk.
Kodutöö
1. Nr 1,2 (lk 39) Rudzitis G.E. Keemia. Üldkeemia alused. 10. klass: õpik õppeasutustele: algtase / G. E. Rudzitis, F.G. Feldman. - 14. trükk. - M.: Haridus, 2012.
2. Miks on etüleeni seeria süsivesinikes isomeeride arv suurem kui küllastunud süsivesinikes?
3. Millistel süsivesinikel on ruumilised isomeerid?
cis-trans-isomeeria või geomeetriline isomeeria- üks stereoisomerismi tüüpidest: see seisneb võimaluses, et asendajad paiknevad kaksiksideme või mittearomaatse tsükli tasapinna ühel või vastaskülgedel. Kõik geomeetrilised isomeerid on diastereomeerid, kuna need ei ole üksteise peegelpildid. cis- ja transs-isomeere leidub nii orgaaniliste kui ka anorgaaniliste ühendite hulgas. Mõisted cis ja transs ei kasutata konformeeride puhul, kaks kergesti üksteisesse voolavat geomeetriat, nende asemel kasutatakse tähiseid "syn" ja "anti".
Nimetused « cis" ja " transs» tuli ladina keelest, sellest keelest tõlgituna cis tähendab "ühel küljel" ja transs- "teisel pool" või "vastupidi". Mõistet "geomeetriline isomeeria" peetakse IUPAC-i järgi vananenud sünonüümiks cis-transs-isomeeria.
Seda tuleks meeles pidada cis-trans- kirjeldab nomenklatuur sugulane asendajate paigutus ja seda ei tohiks segi ajada E,Z- nomenklatuur, mis annab absoluutne stereokeemiline kirjeldus ja kehtib ainult alkeenide kohta.
cis-trans Alitsüklilistel ühenditel on ka -isomeeria, milles asendajad võivad paikneda tsükli tasapinna ühel või vastaskülgedel. Näiteks on 1,2-diklorotsükloheksaan:
 |
  |
| transs-1,2-diklorotsükloheksaan | cis-1,2-diklorotsükloheksaan |
 |
 |
| cis-2-penteen | transs-2-penteen |
 |
 |
| cis-1,2-dikloroetüleen | transs-1,2-dikloroetüleen |
 |
 |
| cis-buteendioonhape (maleiinhape) |
transs-buteendioonhape (fumaarhape) |
 |
 |
| Oleiinhape | Elaidiinhape |
Erinevused võivad olla väikesed, nagu see on sirge ahelaga alkeenide, näiteks 2-penteeni keemistemperatuuri puhul. cis-isomeer, mille keeb temperatuuril 37 °C, ja transs-isomeer - 36 °C juures. Erinevus vahel cis- ja transs- muutub veelgi suuremaks, kui molekulis on polariseeritud sidemeid, nagu 1,2-dikloroetüleen. cis-isomeer keeb sel juhul temperatuuril 60,3 °C, kuid transs-isomeer keeb temperatuuril 47,5 °C. Millal cis-isomeeride efekt kahest polaarsest C-Cl sidemest moodustab tugeva molekulaarse dipooli, mis tekitab tugevaid molekulidevahelisi interaktsioone (Keesomi jõud), mis suurendavad dispersioonijõude ja põhjustavad keemistemperatuuri tõusu. AT transs-isomeer, vastupidi, seda ei juhtu, kuna C-Cl sidemete kaks momenti asuvad üksteise vastas ja tühistavad üksteist täiendavat dipoolmomenti tekitamata (kuigi nende kvadrupoolmoment pole üldse null).
Buteenidihappe kaks geomeetrilist isomeeri on oma omaduste ja reaktsioonivõime poolest nii erinevad, et neil on isegi erinevad nimed: cis-isomeeri nimetatakse maleiinhappeks ja transs-isomeer - fumaarhape. Peamine omadus, mis määrab suhtelise keemistemperatuuri, on molekuli polaarsus, kuna see suurendab molekulidevahelisi interaktsioone, tõstes seeläbi keemistemperatuuri. Samamoodi määrab sümmeetria sulamistemperatuuri, kuna sümmeetrilised molekulid pakendavad tahkes olekus paremini, isegi kui molekuli polaarsus ei muutu. Sellise sõltuvuse üheks näiteks on oleiin- ja elaidiinhape; oleiinhape, cis-isomeer, sulamistemperatuur on 13,4 °C ja muutub toatemperatuuril vedelaks, samas transs-isomeeri, elaidiinhappe sulamistemperatuur on kõrgem, 43 °C, kuna see on otsesem transs-isomeeri tihend on tihedam ja püsib toatemperatuuril tahke.
cis-trans-dikarboksüülhapete isomeerid erinevad ka happesuse poolest: maleiinhape ( cis) on oluliselt tugevam hape kui fumaar ( transs). Niisiis, fumaarhappe esimene dissotsiatsioonikonstant pK a1= 3,03 ja maleiinhappe jaoks pK a1= 1,9. Vastupidi, fumaarhappe teise karboksüülrühma dissotsiatsioonikonstant on suurem kui malehappe puhul, nimelt: fumaarhappe puhul. pK a2= 4,44 ja maleiinhappe jaoks pK a2= 6,07. Karboksüülrühmade ruumilise läheduse tõttu cis- vorm, suureneb vesiniku kalduvus ioniseerida, seega on malehappe esimene konstant suurem. Teisel prootonil on aga keerulisem ületada kahe lähedase karboksüülrühma külgetõmbejõudu cis-isomeer, seega on maleiinhappe teine dissotsiatsioonikonstant väiksem kui fumaarhappel. Sarnane põhimõte kehtib ka alitsükliliste dikarboksüülhapete kohta, kuid tsükli suuruse suurenedes tuleks arvesse võtta ka mittetasapinnalise rõnga kuju mõju.
Vicinaalne tuuma spin-spin sidestuskonstant (3 J HH) mõõdetud NMR-spektroskoopiaga, rohkem transs-isomeerid (vahemik: 12-18 Hz; keskmine: 15 Hz) kui jaoks cis-isomeerid (vahemik: 0-12 Hz; keskmine: 8 Hz).
Reeglina atsükliliste süsteemide jaoks transs cis. Selle põhjuseks on tavaliselt tihedalt asetsevate asendajate soovimatute steeriliste interaktsioonide tugevdamine cis-isomeer. Samal põhjusel ka eripõlemissoojus transs-isomeerid madalamad kui cis, mis näitab suuremat termodünaamilist stabiilsust. Selle reegli erandid on 1,2-difluoroetüleen, 1,2-difluorodiaseen (FN=NF), 1-bromopropeen-1 ja mitmed teised halogeen- ja hapnikuasendatud etüleenid. Sel juhul cis-isomeer on stabiilsem kui transs-isomeer, kuna selliste asendajate vahel ei domineeri mitte tõukejõud, vaid tõmbejõud (näiteks Londoni jõud). Lisaks ei teki asendajate suhteliselt väikese mahu tõttu steerilisi takistusi. 1,2-dihaloetüleenidest on ainult 1,2-dijodoetüleenil stabiilsem trans-isomeer kui cis-isomeer, sest suure raadiuse tõttu kogevad joodiaatomid tugevat ruumilist vastasmõju, kui nad asuvad kaksiksidemega samal küljel.
Geomeetrilised isomeerid, mille erinevus on seotud kaksiksideme ümber olevate asendajate asendiga, erinevad erinevat tüüpi stereoisomeeridest - konformeeridest. Eraldi olemasolu cis- ja transs-isomeerid on sisuliselt võimalikud ainult tänu kõrgele kaksiksideme ümber pöörleva energiabarjäärile, mis võimaldab eraldada olemasolu cis- ja transs-isomeerid, samas kui konformeerid eksisteerivad ainult tasakaalulise seguna. Topeltsideme ümber pöörleva tõkke väärtus lihtsates alkeenides on 250-270 kJ/mol. Kui aga tugevad elektronidoonorid (-SR) asetatakse ühele küljele ja rühmad, tugevad elektroni aktseptorid (-CN, -COC 6 H 5) asetatakse teisele poole, polariseerides nii kaksiksidet, toob see kaasa märkimisväärse pöörlemisbarjääri vähenemine. Sel viisil polariseeritud sideme ümber pöörlemise takistust saab vähendada 60-100 kJ/mol-ni. Madalad energiatõkked, kui energia erinevus cis-trans-isomeerid ja konformeerid on silutud, leitud atsetoäädikhappe estri ja enaminoketoonide amiini derivaatide puhul. On näidatud, et sellistes süsteemides olev tasakaaluasend sõltub lahusti olemusest. Seega on enaminoketoonid mittepolaarsetes lahustites 100% ulatuses cis- sisemise vesiniksidemega stabiliseeritud vorm ja polaarsetes lahustites kuni 50% transs-vormid.
noodisüsteem cis-transs on hästi kasutatav ainult isomeersete alkeenide nimetamisel, mille kaksiksideme juures on kaks erinevat tüüpi asendajat, komplekssetes molekulides muutub selline nomenklatuur liiga ebamääraseks. Nendel juhtudel on välja töötatud IUPAC E,Z- tähistus, mis määratleb üheselt ühendite nimetused kõigil võimalikel juhtudel ja on seetõttu eriti kasulik tri- ja tetra-asendatud alkeenide nimetamisel. See süsteem väldib segadust selle üle, milliseid rühmi tuleks arvesse võtta. cis- või transs- üksteise suhtes.
Kui kaks vanemat rühma asuvad kaksiksideme samal küljel, see tähendab, et nad on sees cis- positsiooni üksteise suhtes, siis sellist ainet nimetatakse Z-isomeer (saksa sõnast zusammen - koos). Kui vanemad rühmad asuvad kaksiksideme vastaskülgedel (in transs-orientatsioon), siis sellist isomeeri nimetatakse E-isomeer (saksa keelest entgegen - vastand). Rühmade ja aatomite paremusjärjestus määratakse Kahn - Ingold - Prelogi reeglitega. Iga kaksiksideme kahe aatomi puhul on vaja kindlaks määrata iga asendaja vanemus. Kui mõlemad vanemad asendajad asuvad π-sideme tasapinna samal küljel, tähistatakse seda konfiguratsiooni sümboliga Z, kui need rühmad asuvad π-side tasandi vastaskülgedel, siis tähistatakse konfiguratsiooni sümboliga E .
Tuleb märkida, et cis/transs ja E,Z-nomenklatuurid põhinevad seetõttu alkeenide erinevate asendajate võrdlusel Z-isomeer ei ühti alati cis-isomeer ja E-isomeer - transs-isomeer. Näiteks, transs-2-klorobuteen-2 (kaks metüülrühma C1 ja C4, buteen-2a põhiahelas on transs-orientatsioon) on ( Z)-2-klorobuteen-2 (kloor on vanem kui metüül, mis omakorda on vanem kui vesinik, seega käsitletakse kloori ja C4-metüüli koos).
cis–transs-isomeeriat leidub ka anorgaanilistes ühendites, eelkõige diaseenides ja kompleksühendites.
Diaseene (ja nendega seotud difosfeene) eksponeeritakse cis-trans- isomeeria. Nagu orgaaniliste ühendite puhul, cis-isomeer on reaktiivsem, ainult ta suudab alkeene ja alküüne alkaanideks redutseerida. Trance-isomeer, mis läheneb alkeenile, ei suuda oma vesinikuaatomeid järjestada, et alkeeni tõhusalt redutseerida, ja cis-isomeer saab selle ülesandega edukalt hakkama tänu sobivale vormile.
  |
  |
| transs- diaseen | cis- diaseen |
Oktaeedrilise või tasapinnalise ruudu geomeetriaga anorgaanilised koordinatsiooniühendid jagunevad samuti järgmisteks osadeks: cis-isomeerid, milles samad ligandid paiknevad kõrvuti, ja transs-isomeerid, milles ligandid on üksteisest eraldatud.
Näiteks Pt(NH 3) 2 Cl 2 jaoks eksisteerib kaks ruudukujulist tasapinnalist geomeetrilist isomeeri – nähtust, mida Alfred Werner selgitas 1893. aastal. cis-isomeer täisnimega cis-diklorodiamiinplaatina(II) omab kasvajavastast toimet, mida näitas Barnett Rosenberg 1969. aastal. Nüüd tuntakse seda ainet keemiaravis lühinime tsisplatiin all. Trance-isomeeril (transplatiin), vastupidi, ei oma meditsiinilist toimet. Kõiki neid isomeere saab sünteesida trans-efekti alusel, mis võimaldab saada valdavalt soovitud isomeeri.
 |
 |
|
cis- + ja transs- + |
||
Oktaeedriliste komplekside puhul valemiga MX 4 Y 2 on samuti kaks isomeeri. (Siin on M metalliaatom ning X ja Y on erinevat tüüpi ligandid.) cis-isomeer, kaks Y ligandi külgnevad üksteisega 90° nurga all, nagu on näidatud klooriaatomite puhul cis- + vasakul pildil. AT transs-isomeer näidatud paremal, kaks klooriaatomit asuvad keskmist koobaltiaatomit läbiva diagonaali vastasotstes.
Sarnast tüüpi MX 3 Y 3 oktaeedriliste komplekside isomeeria on grand os-isomeeria või näo-aksiaalne isomeeria, kui sees on teatud arv ligande cis- või transs- positsioon üksteise suhtes. AT gran- isomeerid, sama tüüpi ligandid hõivavad oktaeedri kolmnurkse külje tipud ja os-isomeerid, samad ligandid on kolmes kõrvutiasendis, nii et kaks ligandi on keskaatomi vastaskülgedel ja sellega samal teljel
Geomeetrilised isomeerid tekivad siis, kui aatomite vaba pöörlemine molekulis on kaksiksideme olemasolu tõttu piiratud. Maleiinhape (12,23) ja fumaarhape (12,24) (vastavalt cis- ja trans-) võivad olla sellise isomeeripaari näited.
Geomeetrilised isomeerid on keemilise struktuuri poolest väga sarnased, kuid nad ei ole üksteise peegelpildid ega pööra valguse polarisatsioonitasapinda. Reeglina erinevad cis- ja trans-isomeerid oluliselt füüsikaliste omaduste poolest. Näiteks maleiinhape (12,23) sulab 130°C juures, selle pKa väärtus on 1,9, see lahustub hästi külmas vees (79 g 100 ml kohta); selle geomeetrilise isomeeri - fumaarhappe (12,24) konstandid on vastavalt 287 ° C, 3,0 ja 0,7 g 100 ml kohta. Pole üllatav, et geomeetrilistel isomeeridel on erinevad bioloogilised omadused ja seetõttu on uue ühendi keemilise valemi uurimisel väga oluline võtta arvesse kõiki seda tüüpi isomeeria olemasolu võimalusi.
Cis- ja trans-isomeere saab kergesti eraldada kristallimise või kromatograafiaga. Puudub üldine meetod ühe isomeeri muundamiseks teiseks, kuid kuumutamine annab üldiselt kõige stabiilsema isomeeri ja valguse käes vähem stabiilse isomeeri. Inimese nägemine sõltub võrkkesta 11-cis-isomeeri muutumisest valguse toimel 11-trans-vormiks. Niipea kui põnev valgusvihk kaob,
see karotenoidpigment läheb uuesti cis-vormi, katkestades sellega ajju mineva impulsi.Cis- ja trans-isomeerid eksisteerivad ka lameda tsüklopentaani ringi juures, mis on justkui suur kaksikside. Kuigi tsükloheksaani tsükkel ei ole üldse tasapinnaline, on see siiski piisavalt tasane, et moodustada cis- ja trans-isomeere. Seega eksisteerivad ja on saadaval nii diaminotsükloheksaani cis- (12,25) kui ka trans- (12,26) vormid. Üks ja sama molekul võib moodustada nii geomeetrilisi kui ka optilisi isomeere. Näiteks saab trans-isomeeri (12.26) eraldada (S,S) (12.27) ja (R.R) (12.28) kiraalseteks isomeerideks. Kuid cis-isomeeri ei saa jagada kiraalseteks vormideks, kuna sellel on sümmeetriatasand. Benseenitsüklil ei ole geomeetrilisi isomeere, kuna tsükli igal süsinikuaatomil on ainult üks asendaja.
Cis-Trans-TpaHC-(S S) TpaHC-(R.R) (12.25) (12.26) (12.27) (12.28) |
1,2-diaminotsinlogensaani stereoisomeerid
Mõnikord on cis- või trans-konfiguratsiooni määramiseks keeruline kaksiksideme neljast asendajast kahte valida. Järjestusreegel näeb ette kõige raskemate aatomitega asendajate valiku, cis-vormi tähistatakse aga tähega Z (saksakeelsest sõnast zusammen) ja teisendust tähega E (entgegen). Mõnikord tähistatakse ühendite nimetustes, milles geomeetriline isomeeria võib korduvalt avalduda, väikseima numbriga asendajat (vastavalt numeratsioonireeglile) tähega r ning tähistusi c-(cis) ja t-(trans) teiste asendajate ees näitavad nende positsiooni hr asetäitja suhtes.
Sarnaselt taimerakkude kasvu stimuleerivale indool-3-üüläädikhappele (4,82) võivad toimida ka teised karboksüülhapped, mille karboksüülrühm on aromaatse ringi tasandi suhtes nurga all. Geomeetriline isomeeria piirab kahe asendaja sellise paigutuse võimalust, seetõttu on kaneelhapetest aktiivne ainult cis-isomeer. 2-fenüültsüklopropaan-1-karboksüül- ja 1,2,3,4-tetrahüdronaftalideen-huääthapetes on samuti aktiivsed ainult cis-isomeerid. Molekulaarsed mudelid näitavad, et tsükkel ja karboksüülrühm nende ainete trans-isomeeris (inaktiivses) asuvad samal tasapinnal, samas kui cis-vormis (aktiivses) ei ole need samatasapinnalised. Ta tõi esimesena välja selle seose mitte-kaplanaarsuse ja Veidstra kasvu stimuleeriva tegevuse vahel. Mittetasapinnalisus võib tekkida ka steeriliste takistuste tõttu. Seega on bensoehape lameda kujuga ja ei ole aktiivne, samas kui 2,6-diklorobensoehape ja 8-metüül-1-naftoehape on mittetasapinnalised ja bioloogiliselt aktiivsed.
Auksiinide analoogides saab karboksüülrühma asendada ka teiste elektrone eemaldavate rühmadega (-CN, -N02, -SO3H), kusjuures bioloogiline aktiivsus väheneb vaid veidi. Struktuuri ja tegevuse vahelise seose kohta selles sarjas vt Koepfli, Thimann, Went (1938) ja Veidstra
Steroidide geomeetriline isomeeria väärib erilist tähelepanu. Valem (12.29) näitab selle looduslike küllastunud ühendite rühma üldist struktuuri (näidatud on süsinikuaatomite nummerdamine ja nelja tsükli tähttähised). Looduslikes steroidides on B- ja C-rõngad trans-ristmikus, mis mõlemad on ankurdatud tooli konformatsiooni. Südameglükosiidides on tsüklite C ja D ühenduskohal cis-konfiguratsioon, loomsetes hormoonides, steroolides ja sapphapetes aga trans-ühendus. Enamikus bioloogiliselt aktiivsetes steroidides on A- ja B-rõngad trans-ristmikus (rida "5a", varem nimetati "allo"). Iga steroidi molekuli rõngas moodustab voldid, mis on selgelt näha valemi (12.30) külgprojektsioonis.
Tähis "5a" näitab, et vesinikuaatom asendis 5 on tsüklite ühisest tasapinnast allpool. Kõik selle tasandi all asuvad asendajad on tähistatud sümboliga "a" ja ülal - valemites (12.34) ja (12.35) näidatud sümboliga.
Tooli kuju on kõige vähem pingestatud ja seetõttu tsükloheksaani molekuli jaoks kõige eelistatavam, kusjuures iga aksiaalne vesinikuaatom on 0,25 nm kaugusel kahest teisest tsükli samal küljel asuvast aksiaalsest vesinikuaatomist. Keerdunud (või keerd-) kuju on vahepealne (tooli ja paadi kujundite vahel) ning kõige pingelisem on vanni kuju. Viimast võib aga stabiliseerida kahe või enama sobivaid asendajaid sisaldava kondenseerunud tsükliga. Dekahüdronaftaleeni (dekaliini) molekul võib eksisteerida kahe stabiilse vormina, mille struktuur määrati elektronide difraktsiooni abil, mis näitas, et trans-vorm (sulamistemperatuur -30 ° C, keemistemperatuur 117 ° C 100 mm Hg juures) koosneb kahest trans-sulatatud rõngast tooli konformatsioonis ja cis-vorm (sulamistemperatuur -43 °C, keemistemperatuur 124 °C 100 mm Hg juures) koosneb kahest cis-sulatatud rõngast tooli konformatsioonis. Cis-vorm muundatakse trans-vormiks kõrgendatud temperatuuril ja katalüsaatori juuresolekul. Dekaliini molekul on näide geomeetrilisest isomeeriast sildsüsiniku suhtes, kuid iga tsükkel jääb konformatsiooniliselt liikuvaks.
Huvipakkuv on -CO-H- sideme konformatsioonianalüüs, mis määrab peptiidide struktuuri. Valkudes on selle konformatsioon alati “pikenenud” (trans), kuigi proliini, st tertsiaarset amiidrühma sisaldavates peptiidides on tasakaalulise “varjatud” (cis) konformatsiooni osakaal üsna suur (kuni 40%). Sekundaarsetes formamiidides on N-metüülformamiidi (12,39, 12,40) puhul "pikenenud" ja "varjatud" konformeeride tasakaaluline segu vahekorras 8:92. Nende olemasolu tehti kindlaks kahe erineva signaali olemasoluga PMR-spektrites. Lämmastikuaatomi juures oleva asendaja mahu suurenemisega suureneb "pikendatud" konformeeri osakaal, ulatudes 18% -ni, kui metüülrühm asendatakse tert-butüülrühmaga.