
cis-trans-izomerie sau izomerie geometrică- unul dintre tipurile de stereoizomerie: constă în posibilitatea ca substituenţii să fie localizaţi pe una sau pe laturile opuse ale planului dublei legături sau ciclului nearomatic. Toți izomerii geometrici sunt diastereomeri, deoarece nu sunt imagini în oglindă unul a celuilalt. cis- și transă-izomerii se gasesc atat printre compusii organici cat si printre anorganici. Concepte cisși transă nu sunt folosite în cazul conformerelor, două geometrii care curg cu ușurință una în alta, se folosesc în schimb denumirile „syn” și „anti”.
Denumiri « cis" și " transă» provenea din latină, tradus din această limbă cisînseamnă „pe o parte” și transă- „de cealaltă parte” sau „opus”. Termenul „izomerie geometrică” conform IUPAC este considerat un sinonim învechit cis-transă-izomerie.
Trebuie amintit că cis-trans- descrie nomenclatura relativ aranjamentul substituenților și nu trebuie confundat cu E,Z- o nomenclatură care dă absolut descriere stereochimică și se aplică numai alchenelor.
cis-trans Compușii aliciclici prezintă, de asemenea, izomerie, în care substituenții pot fi localizați pe una sau pe părțile opuse ale planului inelar. Un exemplu este 1,2-diclorociclohexanul:
 |
  |
| transă-1,2-diclorociclohexan | cis-1,2-diclorociclohexan |
 |
 |
| cis-2-pentene | transă-2-pentene |
 |
 |
| cis-1,2-dicloretilenă | transă-1,2-dicloretilenă |
 |
 |
| cis-acid butendioic (acid maleic) |
transă-acid butendioic (acid fumaric) |
 |
 |
| Acid oleic | Acid elaidic |
Diferențele pot fi subtile, așa cum este cazul punctului de fierbere al alchenelor cu lanț drept, cum ar fi 2-pentena. cis-izomer din care fierbe la 37 °C, și transă-izomer - la 36 °C. Diferență între cis- și transă- devine și mai mare dacă în moleculă există legături polarizate, ca în 1,2-dicloretilenă. cis-izomer în acest caz fierbe la 60,3 ° C, dar transă-izomerul fierbe la 47,5 °C. Când cis-efectul izomer de la două legături C-Cl polare se adună pentru a forma un dipol molecular puternic, care dă naștere la interacțiuni intermoleculare puternice (forțe Keesom), care se adaugă la forțele de dispersie și duc la creșterea punctului de fierbere. LA transă-izomer, dimpotrivă, acest lucru nu se întâmplă, deoarece cele două momente ale legăturilor C–Cl sunt situate unul față de celălalt și se anulează unul pe celălalt fără a crea un moment dipol suplimentar (deși momentul lor cvadrupol nu este deloc zero).
Cei doi izomeri geometrici ai acidului butendioic sunt atât de diferiți în proprietăți și reactivitate, încât au primit chiar denumiri diferite: cis-izomerul se numește acid maleic și transă-izomer - acid fumaric. Proprietatea cheie care determină punctul relativ de fierbere este polaritatea moleculei, deoarece îmbunătățește interacțiunile intermoleculare, ridicând astfel punctul de fierbere. În același mod, simetria determină punctul de topire, deoarece moleculele simetrice se împachetează mai bine în stare solidă, chiar dacă polaritatea moleculei nu se modifică. Un exemplu de astfel de dependență este acizii oleic și elaidic; acid oleic, cis-izomer, are un punct de topire de 13,4 °C și devine lichid la temperatura camerei, în timp ce transă-izomerul, acidul elaidic, are un punct de topire mai mare de 43 °C deoarece este mai direct transă-izomerul are un ambalaj mai dens și rămâne solid la temperatura camerei.
cis-trans-izomerii acizilor dicarboxilici difera si ca aciditate: acid maleic ( cis) este un acid semnificativ mai puternic decât fumaric ( transă). Deci, prima constantă de disociere pentru acidul fumaric pK a1= 3,03, iar pentru acidul maleic pK a1= 1,9. Dimpotrivă, constanta de disociere a celei de-a doua grupări carboxil pentru acidul fumaric este mai mare decât pentru acidul maleic și anume: pentru acidul fumaric pK a2= 4,44, iar pentru acidul maleic pK a2= 6,07. Datorită proximității spațiale a grupărilor carboxil în cis- forma, tendinta hidrogenului de a ioniza creste, deci prima constanta a acidului maleic este mai mare. Cu toate acestea, este mai dificil pentru al doilea proton să depășească atracția a două grupări carboxil apropiate în cis-izomer, deci a doua constantă de disociere a acidului maleic este mai mică decât cea a acidului fumaric. Un principiu similar se aplică acizilor dicarboxilici aliciclici, cu toate acestea, pe măsură ce dimensiunea inelului crește, trebuie luată în considerare și influența formei inelului neplan.
Constanta de cuplare spin-spin nuclear vicinal (3 J HH) măsurată prin spectroscopie RMN, mai mult pentru transă-izomeri (interval: 12-18 Hz; medie: 15 Hz) decât pentru cis-izomeri (interval: 0-12 Hz; medie: 8 Hz).
De regulă pentru sistemele aciclice transă cis. Motivul pentru aceasta este, de obicei, de a îmbunătăți interacțiunile sterice nedorite ale substituenților strâns distanțați în cis-izomer. Din același motiv, căldura specifică de ardere transă-izomeri mai mici decât cis, ceea ce indică o stabilitate termodinamică mai mare. Excepții de la această regulă sunt 1,2-difluoretilenă, 1,2-difluorodiazen (FN=NF), 1-bromopropen-1 și alte câteva etilene substituite cu halogen și oxigen. În acest caz cis-izomerul este mai stabil decât transă-izomer, deoarece între astfel de substituenți nu predomină forțele de respingere, ci forțele atractive (cum ar fi forțele londoneze). În plus, datorită volumului relativ mic de substituenți, nu apare o piedică sterică. Dintre 1,2-dihaloetilene, doar 1,2-diiodoetilena are un izomer trans mai stabil decât cis-izomer, deoarece datorită razei mari, atomii de iod experimentează o interacțiune spațială puternică dacă se află pe aceeași parte a dublei legături.
Izomerii geometrici, a căror diferență este legată de poziția substituenților în jurul legăturii duble, diferă de formele stereoizomerice de alt tip - conformerii. Existenta separata cis- și transă-izomerii, în esență, este posibil doar datorită barierei energetice mari de rotație în jurul legăturii duble, care face posibilă separarea existenței cis- și transă-izomerii, în timp ce conformerii există doar sub forma unui amestec de echilibru. Valoarea barierei de rotație în jurul dublei legături în alchene simple este de 250-270 kJ/mol. Totuși, dacă pe o parte sunt plasați donatori de electroni puternici (-SR), iar pe cealaltă sunt plasați grupuri, acceptori de electroni puternici (-CN, -COC 6 H 5), polarând astfel legătura dublă, aceasta va duce la o semnificativă scăderea barierei de rotație. Bariera de rotație în jurul unei legături astfel polarizate poate fi redusă la 60-100 kJ/mol. Bariere energetice scăzute atunci când diferența de energie între cis-trans-se netezesc izomerii și conformerii, găsiți pentru derivații aminei ai esterului acetoacetic și enaminocetonelor. Se arată că poziția de echilibru în astfel de sisteme depinde de natura solventului. Astfel, enaminocetonele din solvenții nepolari sunt 100% prezente în cis-formă stabilizată printr-o legătură internă de hidrogen, iar în solvenți polari până la 50% transă-forme.
sistem de notație cis-transă este bine aplicabil numai la denumirea alchenelor izomerice cu două tipuri diferite de substituenți la dubla legătură, în moleculele complexe o astfel de nomenclatură devine prea vagă. În aceste cazuri, IUPAC dezvoltat E,Z- o notație care definește în mod unic numele compușilor pentru toate cazurile posibile și, prin urmare, este utilă în special pentru denumirea alchenelor tri- și tetra-substituite. Acest sistem evită confuzia cu privire la grupurile care trebuie luate în considerare. cis- sau transă- în relaţie între ele.
Dacă cele două grupuri mai vechi sunt situate pe aceeași parte a legăturii duble, adică sunt în cis- poziție unul față de celălalt, atunci se numește o astfel de substanță Z-izomer (din germană zusammen - împreună). Când grupurile mai vechi sunt situate pe părți opuse ale dublei legături (in transă-orientare), atunci se numește un astfel de izomer E-izomer (din germana entgegen - opus). Ordinea de prioritate a grupurilor și atomilor este determinată de regulile lui Kahn - Ingold - Prelog. Pentru fiecare dintre cei doi atomi din dubla legătură, este necesar să se determine vechimea fiecărui substituent. Dacă ambii substituenți seniori sunt localizați pe aceeași parte a planului de legătură π, atunci această configurație este indicată prin simbol Z, dacă aceste grupuri sunt pe părți opuse ale planului legăturii π, atunci configurația este notă cu simbolul E .
Trebuie remarcat faptul că cis/transăși E,Z-nomenclaturile se bazează pe compararea diferiților substituenți ai alchenelor, așadar Z-izomerul nu se potrivește întotdeauna cis-izomer, și E-izomer - transă-izomer. De exemplu, transă-2-clorbuten-2 (două grupe metil C1 și C4, pe lanțul principal al buten-2a sunt în transă-orientare) este ( Z)-2-clorbutenă-2 (clorul este mai vechi decât metil, care la rândul său este mai vechi decât hidrogenul, astfel încât clorul și C4-metilul sunt considerate împreună).
cis–transă-izomeria se găsește și în compușii anorganici, în primul rând în diazene și compuși complecși.
Diazenele (și difosfenele înrudite) prezintă cis-trans- izomerie. Ca și în cazul compușilor organici, cis-izomerul este mai reactiv, doar că este capabil să reducă alchenele și alchinele la alcani. Transă-izomerul, care se apropie de alchenă, nu își poate alinia atomii de hidrogen pentru a reduce eficient alchena și cis-izomer datorită formei adecvate face față cu succes acestei sarcini.
  |
  |
| transă- diazen | cis- diazen |
Compușii anorganici de coordonare cu geometrie pătrată octaedrică sau plană sunt de asemenea subdivizați în cis-izomeri in care aceiasi liganzi sunt situati unul langa altul, si transă-izomeri în care liganzii sunt separați unul de celălalt.
De exemplu, există doi izomeri geometrici planari pătrați pentru Pt(NH 3) 2 Cl 2 , un fenomen pe care Alfred Werner l-a explicat în 1893. cis-izomer cu nume complet cis-diclorodiaminoplatina(II) are activitate antitumorală, care a fost demonstrată de Barnett Rosenberg în 1969. Acum această substanță este cunoscută în chimioterapie sub denumirea scurtă de cisplatină. Transă-izomerul (transplatina), dimpotrivă, nu are activitate medicinală. Fiecare dintre acești izomeri poate fi sintetizat pe baza efectului trans, ceea ce face posibilă obținerea predominant a izomerului dorit.
 |
 |
|
cis- + și transă- + |
||
Pentru complexele octaedrice cu formula MX 4 Y 2, există și doi izomeri. (Aici M este un atom de metal, iar X și Y sunt tipuri diferite de liganzi.) cis-izomer, doi liganzi Y sunt adiacenți unul altuia la un unghi de 90°, așa cum se arată pentru atomii de clor din cis- + în poza din stânga. LA transă-izomer prezentat in dreapta, doi atomi de clor sunt situati la capetele opuse ale diagonalei care trece prin atomul central de cobalt.
Un tip similar de izomerie a complexelor octaedrice MX 3 Y 3 este grand os-izomerie, sau izomerie axială față, când un anumit număr de liganzi sunt în cis- sau transă- poziție unul față de celălalt. LA gran-izomerii, liganzii de acelasi tip ocupa varfurile fetei triunghiulare a octaedrului, iar in os-izomeri, aceiași liganzi sunt în trei poziții adiacente, astfel încât doi liganzi se află pe părțile opuse ale atomului central și pe aceeași axă cu acesta
Izomerii geometrici apar atunci când rotația liberă a atomilor dintr-o moleculă este limitată din cauza prezenței unei duble legături. Acizii maleic (12.23) și fumaric (12.24) (respectiv cis și trans) pot servi ca exemplu pentru o astfel de pereche de izomeri.
Izomerii geometrici sunt foarte asemănători ca structură chimică, dar nu sunt imagini în oglindă unul de altul și nu rotesc planul de polarizare a luminii. De regulă, izomerii cis și trans diferă semnificativ în ceea ce privește proprietățile fizice. De exemplu, acidul maleic (12,23) se topește la 130°C, valoarea lui pKa este de 1,9, este foarte solubil în apă rece (79 g la 100 ml); constantele izomerului său geometric - acid fumaric (12.24) sunt, respectiv, 287 ° C, 3,0 și 0,7 g la 100 ml. Nu este surprinzător faptul că izomerii geometrici au proprietăți biologice diferite și, prin urmare, este foarte important atunci când se studiază formula chimică a unui nou compus să se țină cont de toate posibilitățile de existență a acestui tip de izomerie.
Izomerii cis și trans pot fi separați cu ușurință prin cristalizare sau cromatografie. Nu există o metodă generală de conversie a unui izomer în altul, dar încălzirea produce în general izomerul cel mai stabil, iar expunerea la lumină produce izomerul mai puțin stabil. Vederea umană depinde de conversia izomerului 11-cis al retinei în forma 11-trans sub acțiunea luminii. De îndată ce raza de lumină incitantă dispare,
acest pigment carotenoid intră din nou în forma cis, întrerupând astfel impulsul care merge către creier.
Izomerii cis și trans există și în inelul ciclopentan plat, care este ca o legătură dublă mare. Deși ciclul ciclohexan nu este deloc plan, este totuși suficient de plan pentru a forma izomeri cis și trans. Astfel, ambele forme cis- (12.25) și trans- (12.26) de diaminociclohexan există și sunt disponibile. Aceeași moleculă poate forma atât izomeri geometrici, cât și optici. De exemplu, izomerul trans (12.26) poate fi separat în izomerii chirali (S,S) (12.27) și (R,R) (12.28). Cu toate acestea, izomerul cis nu poate fi împărțit în forme chirale, deoarece are un plan de simetrie. Inelul benzenic nu are izomeri geometrici, deoarece fiecare atom de carbon al inelului are un singur substituent.
Stereoizomeri ai 1,2-diaminocinlogensanului
Este uneori dificil să selectați doi dintre cei patru substituenți pe o legătură dublă pentru a determina configurația cis sau trans. Regula de succesiune prescrie alegerea substituenților cu cei mai grei atomi, în timp ce forma cis este notată cu litera Z (din cuvântul german zusammen), iar transformarea cu litera E (entgegen). Uneori, în denumirile compușilor în care izomeria geometrică se poate manifesta în mod repetat, substituentul care are cel mai mic număr (conform regulii de numerotare) este notat cu litera r, iar denumirile c-(cis) și t-(trans) în în faţa altor substituenţi îşi arată poziţia faţă de domnul deputat.
Similar acidului indol-3-ilacetic (4.82), care stimulează creșterea celulelor vegetale, pot acționa și alți acizi carboxilici, a căror grupare carboxil se află în unghi față de planul inelului aromatic. Izomeria geometrică limitează posibilitatea unui astfel de aranjament a doi substituenți, prin urmare, a acizilor cinamici, doar cizomerul este activ. În acizii 2-fenilciclopropan-1-carboxilic și 1,2,3,4-tetrahidronaftaliden-1-acetic sunt activi doar izomerii cis. Modelele moleculare arată că inelul și gruparea carboxil din izomerul trans (inactiv) al acestor substanțe se află în același plan, în timp ce în forma cis (activă) nu sunt coplanare. El a fost primul care a subliniat această legătură între
necoplanaritatea și activitatea de stimulare a creșterii a Veidstra. Noncoplanaritatea poate apărea și din cauza obstacolelor sterice. Astfel, acidul benzoic are o formă plată și nu este activ, în timp ce acizii 2,6-diclorobenzoic și 8-metil-1-naftoic sunt neplanari și activi biologic.
La analogii auxinelor, gruparea carboxil poate fi înlocuită și cu alte grupări atrăgătoare de electroni (-CN, -NO2, -SO3H), în timp ce activitatea biologică scade doar ușor. Pentru legătura dintre structură și acțiune din această serie, vezi Koepfli, Thimann, Went (1938) și Veidstra (1963).
Izomeria geometrică a steroizilor merită o atenție specială. Formula (12.29) arată structura generală a acestui grup de compuși naturali saturați (se arată numerotarea atomilor de carbon și denumirea literelor celor patru cicluri). În steroizii naturali, inelele B și C sunt într-o joncțiune trans, ambele fiind ancorate într-o conformație de scaun. În glicozidele cardiace, joncțiunea ciclurilor C și D are o configurație cis, dar în hormonii animale, steroli și acizi biliari, are o joncțiune trans. La majoritatea steroizilor activi din punct de vedere biologic, inelele A și B se află într-o joncțiune trans (rândul „5a”, numit anterior „allo”). Fiecare dintre inelele din molecula de steroid formează pliuri, ceea ce se vede clar în proiecția laterală a formulei (12.30).

Denumirea „5a” indică faptul că atomul de hidrogen din poziția 5 se află sub planul comun al inelelor. Toți substituenții aflați sub acest plan sunt desemnați prin simbolul „a”, iar deasupra - prin simbolul „p”. Substituenții a sunt indicați prin linii punctate, iar substituenții ^ prin linii continue. Simbolurile a- și ^- sunt, de asemenea, folosite pentru alți compuși policiclici, de exemplu, triterpene și alcaloizi. Complexitatea structurii acestor compuși face dificilă utilizarea nomenclaturii R și S.
De regulă, la mamifere, activitatea biologică ridicată a compușilor steroizi este asociată cu absența substituenților a în pozițiile 1, 9, 11-13, 17 și absența substituenților p în pozițiile 4-8, 14, 15. Proiecția laterală a moleculei de hidrocortizon ilustrează această regulă. Primul pas în acțiunea biologică a hormonilor steroizi este efectul acestora asupra transportului specific al proteinelor (secțiunea 2.4). Se presupune că steroizii interacționează cu proteinele de partea inferioară plată (suprafața a) a moleculei.
Diferiții steroizi diferă unul de altul în principal prin substituenții R1, R2 și R3 (12.29), dar uneori și prin gradul de nesaturare sau prezența altor substituenți în afara inelelor. Pentru ca un steroid să aibă activitate progestativă, androgenă și corticoidă, de regulă, este necesară prezența unei structuri ciclohexenonei a inelului A. Atomi de oxigen în pozițiile 3, 11 și 17 și grupul caracteristic -CO-CH 2 OH în poziția 17. Activitatea androgenă și corticoidă depinde într-o măsură mai mare de aceste detalii structurale ale moleculei, cu toate acestea, activitatea progestinului este păstrată dacă gruparea acetil din poziția 17 este în configurația a, care nu se găsește în compușii naturali și înlocuirea grupării metil din poziţia 18 cu etil duce chiar la intensificarea acestei activităţi (contraceptiv oral norgestrel).
Dintre toți hormonii steroizi, compușii cu activitate estrogenică impun cele mai puțin stricte cerințe asupra structurii. În condiția aromatizării inelului A și a prezenței unei grupări hidroxil acid în poziția 3, structura restului moleculei are o importanță secundară. În 1938, au apărut analogi simpli de benzen, foarte eficienți, ai estrogenilor steroidieni. Deși se credea că moleculele lor sunt similare ca formă cu cele ale steroizilor, în realitate nu există prea multe în comun între ei. Conform analizei de difracție cu raze X, molecula de dietilstilbestrol (12.31) are o configurație trans, distorsionată din cauza obstacolelor sterice create de fragmentele de metilen a două grupări etil. Prin urmare, două inele de benzen formează un unghi diedru de 63° cu fragmentul de etilenă, ceea ce face ca forma moleculei să fie complet diferită de cea a unui steroid. Cu toate acestea, la aceste molecule, distanța dintre atomii de oxigen este aproximativ aceeași: 1,21 nm în dietilstilbestrol și de la 1,07 la 1,11 nm în estrogeni steroizi, dar toate aceste molecule sunt prea rigide și, prin urmare, nu sunt capabile să interacționeze cu același receptor, în care distanța dintre punctele de legătură este fixă. Se știe că pentru manifestarea activității estrogenice este necesară formarea a două legături de hidrogen ale receptorului cu atomii de oxigen ai ligandului, prin urmare, receptorul trebuie să aibă o anumită flexibilitate. Oki, Urushibara (1952) a remarcat pentru prima dată că efectul dietilstilbestrolului este asociat și cu grosimea moleculei sale, care este de 0,45 nm și este egală cu grosimea moleculelor de estrogeni steroizi.

Dietilstilbestrol 3,4-di (4-hidroxifenil) hex-3-enă
(12.31), un înlocuitor eficient și ieftin pentru principalul hormon feminin estradiol (12.32), a apărut în 1938. Acest medicament sintetic, care se deosebește de hormonul natural prin eficiență ridicată atunci când este administrat pe cale orală și o durată mai lungă de acțiune, a devenit principalul medicament în terapia endocrină. O oarecare neîncredere față de acest medicament a apărut pe baza a doi factori: în primul rând, a fost utilizat pe scară largă pentru a crește greutatea animalelor de fermă și, în al doilea rând, au existat cazuri de cancer la femeile ale căror mame l-au luat în timpul sarcinii. În ciuda acestui fapt, dietilstilbestrolul continuă să fie utilizat pe scară largă și este considerat sigur; nu se prescrie doar in primele trei luni de sarcina (ceea ce, de altfel, se aplica in egala masura si hormonului natural). Pentru utilizarea fosfatului său pentru tratamentul cancerului de prostată, vezi Sec. 4.2. Proprietăți estrogenice similare sunt prezentate de derivatul dihidro dietil-stilbestrol-sinestrol (12.33, a) (configurația 3R, 4S). Se leagă de proteina care leagă estrogenul (secțiunea 2.4) mai puternic decât dietilstilbestrolul însuși, iar omologul său inferior, norhexestrolul (12.33, b), interacționează și mai puternic cu această proteină.
Glicozidele cardiace sunt discutate în Sec. 14.1. Pentru o prezentare detaliată a chimiei și stereochimiei steroizilor, a se vedea Shoppee (1964), biochimie și farmacologie - Briggs, Christie (1977).
Izomeria geometrică a acidului 4-aminocrotonic, care a ajutat la determinarea conformației active a neurotransmițătorului acid gamma-aminobutiric, este discutată în Sec. 12.7.
Configurația include izomeria optică și geometrică.
IZOMERIE OPTICA
În 1815, J. Biot a descoperit existența activității optice pentru compușii organici. S-a constatat că unii compuși organici au capacitatea de a roti planul de polarizare a luminii polarizate. Substanțele care au această capacitate sunt numite optic active.
Dacă un fascicul de lumină obișnuită, în care, după cum se știe, oscilațiile electromagnetice se propagă în planuri diferite perpendiculare pe direcția de propagare a acestuia, este trecut printr-o prismă Nicol, atunci lumina care iese va fi polarizată în plan. Într-un astfel de fascicul, oscilațiile electromagnetice apar doar într-un singur plan. Acest plan se numește plan de polarizare (Fig. 3.2).
Când un fascicul de lumină polarizat trece printr-o substanță optic activă, planul de polarizare se rotește cu un anumit unghi α la dreapta sau la stânga. Dacă substanța deviază planul de polarizare la dreapta (când este observată spre fascicul), se numește dreptaci, dacă la stânga - stângaci. Rotirea la dreapta este indicată de semnul (+), la stânga - de semnul (-).
Orez. 3.2. Schema formării luminii polarizate și rotația planului de polarizare de către o substanță optic activă
Activitatea optică este măsurată cu instrumente numite polarimetre.
Fenomenul de activitate optică este comun în rândul substanțelor organice, în special în rândul celor naturale (hidroxi- și aminoacizi, proteine, carbohidrați, alcaloizi).
Activitatea optică a majorității compușilor organici se datorează structurii lor.
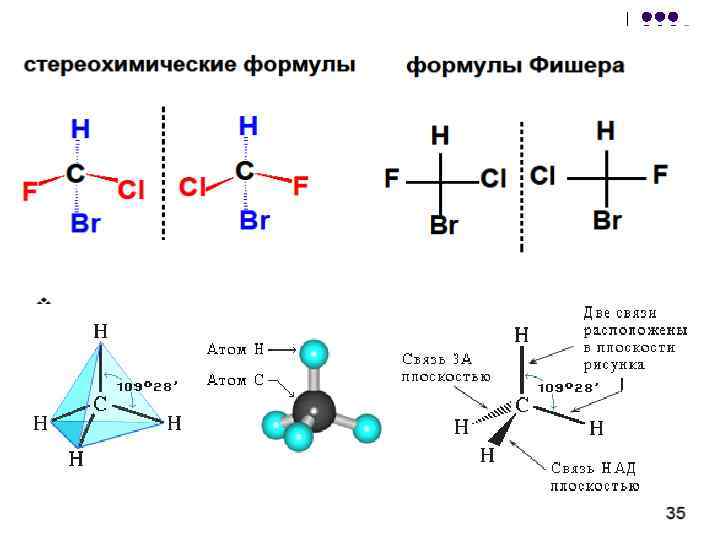
Unul dintre motivele apariției activității optice a moleculelor organice este prezența în structura lor a atomului de carbon sp 3 hibridizat asociat cu patru substituenți diferiți. Un astfel de atom de carbon se numește chiral sau asimetric. Adesea este folosit un nume mai general pentru el - un centru chiral. În formulele structurale, un atom de carbon asimetric este de obicei notat cu un asterisc - C *:

Compușii care conțin un atom de carbon asimetric există ca doi izomeri, legați unul de celălalt ca obiect al imaginii în oglindă. Astfel de izomeri se numesc enantiomeri.

Orez. 3.3. Modele de molecule enantiomerice de bromioclormetan
Formulele stereochimice pot fi folosite pentru a descrie structura spațială a izomerilor optici pe un plan. De exemplu, enantiomerii butanol-2, reprezentați folosind formule stereochimice, sunt după cum urmează:

Cu toate acestea, formulele stereochimice nu sunt întotdeauna convenabile pentru a descrie structura spațială a moleculelor. Prin urmare, izomerii optici sunt reprezentați cel mai adesea pe un plan folosind formulele de proiecție ale lui Fisher. De exemplu, așa arată enantiomerii 2-bromobutanului, reprezentați folosind proiecția Fischer.

Enantiomerii sunt foarte asemănători între ei, dar totuși nu identici. Ei au aceeași compoziție și secvență de atomi de legare într-o moleculă, dar diferă unul de celălalt prin locația lor relativă în spațiu, adică configurația. Este ușor de verificat că aceste molecule sunt diferite atunci când încearcă să-și suprapună modelele unele pe altele.
Proprietatea moleculelor de a nu fi aliniate cu imaginea lor în oglindă se numește chiralitate (din greacă, cheir - mână), iar moleculele sunt numite și chirale. Un bun exemplu sunt mâinile stânga și dreaptă, care sunt imagini în oglindă una ale celeilalte, dar în același timp nu pot fi combinate. Moleculele care sunt compatibile cu imaginea lor în oglindă sunt numite achirale.
Chiralitatea moleculelor este o condiție prealabilă pentru manifestarea activității optice de către o substanță.
Cum se determină dacă o moleculă este chirală? Chiralitatea unei molecule poate fi detectată cu ușurință prin construirea unui model al moleculei și a unui model al imaginii în oglindă, urmate de suprapunerea acestora. Dacă modelele nu se potrivesc, molecula este chirală; dacă se potrivesc, este achirală. Aceeași concluzie poate fi făcută pe baza formulelor stereochimice ale moleculelor prin prezența sau și absența elementelor de simetrie, deoarece motivul activității optice a compușilor organici este structura lor asimetrică. Întrucât molecula este o formațiune tridimensională, structura sa poate fi considerată din punctul de vedere al simetriei formelor geometrice. Principalele elemente de simetrie sunt planul, centrul și axa de simetrie. Dacă nu există un plan de simetrie în moleculă, atunci o astfel de moleculă este chirală.
Enantiomerii au aceleași proprietăți fizice și chimice (punctul de fierbere, punctul de topire, solubilitatea, conductibilitatea electrică și alte constante vor fi aceleași), rotesc planul de polarizare al fasciculului polarizat cu același unghi, dar există diferențe.
Enantiomerii diferă prin semnul de rotație, unul rotește planul de polarizare al fasciculului polarizat la stânga, celălalt la dreapta; ele reacționează la viteze diferite cu alți compuși chirali și există, de asemenea, o diferență în acțiunea fiziologică. De exemplu, medicamentul levomicină este un antibiotic cu spectru larg. Dacă eficiența sa este luată ca 100, atunci forma dextrogirată va fi de numai 2% din eficiența formei levogitoare.
Dacă molecula are un atom asimetric, atunci există sub formă de doi izomeri, dar dacă molecula are mai mulți atomi de carbon asimetrici, atunci numărul de izomeri posibili crește. Numărul de izomeri optici este determinat de formula:
unde N este numărul de izomeri; n este numărul de atomi de carbon asimetrici.
Deci, dacă există doi atomi de carbon asimetrici în moleculă, numărul de izomeri este 2 2 \u003d 4, trei - 2 3 \u003d 8, patru - 2 4 \u003d 16 etc.
De exemplu, acidul bromomalic, care conține doi atomi de carbon asimetrici, există ca patru stereoizomeri (I-IV).

Stereomerii I și II, precum și III și IV, se relaționează unul cu celălalt ca obiect și imaginea lui în oglindă și sunt enantiomeri.
Stereoizomerii 1 și III, 1 și IV, precum și II și HI, H și IV nu sunt imagini în oglindă unul cu celălalt, ei diferă în configurație la unul dintre atomii de carbon asimetrici. Astfel de stereoizomeri sunt numiți diastereoizomeri. Spre deosebire de enantiomerii, diastereomerii au proprietăți fizice și chimice diferite.
Pentru compușii care conțin doi atomi de carbon chirali legați de aceiași substituenți, numărul total de stereoizomeri este redus la trei. De exemplu, acidul tartric trebuie să existe ca patru stereoizomeri (2 2 = 4), dar numai trei sunt cunoscuți. Acest lucru se datorează apariției într-unul dintre stereoizomerii unui astfel de element ca un plan de simetrie.

Stereomerii 1 și II sunt enantiomeri. Stereoizomerul III (forma mezo) este optic inactiv. Molecula de acid mezotartric este achiral. Fiecare enantiomer al acidului tartric, raportat la forma mezo, este un diastereomer.
Nomenclatura izomerilor optici
În nomenclatură, alături de denumirea compusului, sunt indicate și configurația și direcția de rotație a planului luminii polarizate. Acesta din urmă este notat cu un semn (+) pentru un izomer dextrogiro sau cu un semn (-) pentru un izomer levogitor.
Pentru a desemna configurația izomerilor optici, există D, L- și R,S sisteme stereochimice.
D,L-sistem de desemnare configurație. Determinarea configurației absolute a moleculelor s-a dovedit a fi o sarcină dificilă pentru chimiști. Pentru prima dată, acest lucru a fost posibil abia în 1951 prin metoda analizei prin difracție cu raze X. Până în acel moment, configurația izomerilor optici a fost stabilită prin comparație cu o substanță standard special selectată. Această configurație se numește relativă. În 1906, savantul rus M.A. Rozanov a propus gliceraldehida ca standard pentru stabilirea configurației relative,

Pentru izomerul dextrogiro s-a ales formula Fischer, în care gruparea hidroxil la atomul de carbon chiral este în dreapta, iar pentru izomerul stâng este în stânga. Configurația izomerului dextrogiro este notă cu litera D și izomerul stâng cu L.
Folosind gliceraldehida ca standard de referință, a fost dezvoltat un sistem D,L pentru clasificarea stereochimică a compușilor chirali, adică atribuirea compușilor la seria D- sau L-stereochimică, respectiv
Sistemul D,L este utilizat în principal în seria de alcooli polihidroxi, hidroxi, aminoacizi și carbohidrați:

Pentru compușii cu mai mulți atomi de carbon asimetrici, cum ar fi acizii α-piroxi, α-aminoacizii, acizii tartric, configurația este determinată condiționat de atomul de carbon asimetric superior (prin cheia de hidroxi acid), în timp ce în molecula de carbohidrați configurația este (condițional) determinat de atomul de carbon asimetric inferior.

Sistem de desemnare a configurației R,S. D,L- sistemul sa dovedit a fi practic inacceptabil pentru compușii care se aseamănă puțin cu gliceraldehida. Prin urmare, R Kahn, K. Ingold și V. Prelog au propus R,S- un sistem pentru desemnarea configurației absolute a izomerilor optici. R,S- sistemul se bazează pe determinarea vechimii substituenţilor la centrul chiral.
Vechimea substituenților este determinată de valorile numerelor atomice ale elementelor. Cu cât numărul atomic este mai mare, cu atât substituentul este mai vechi. De exemplu, în molecula de bromiodoclormetan, vechimea substituenților scade în seria:

După stabilirea vechimii substituenților, modelul moleculei este orientat astfel încât substituentul cu cel mai mic număr de serie să fie îndreptat în direcția opusă ochiului observatorului. Dacă vechimea celorlalți trei substituenți scade în sensul acelor de ceasornic, atunci molecula are o configurație notată cu litera R (otlat, rectus - dreapta), iar dacă vechimea substituenților scade în sens invers acelor de ceasornic, configurația este notată cu litera S (lat . sinistru – stânga). De exemplu, pentru molecula de bromiodoclormetan:

Fig 3.4. Determinarea configurației prin sistemul R,S pentru molecula de bromiodoclormetan
Luați în considerare definiția vechimii substituenților și configurația pentru molecule mai complexe folosind acid lactic ca exemplu (Fig. 3.4). Deja în primul strat (8 O, b C, 1 H, 6 C) devine clar că substituentul senior este gruparea OH, iar cel junior este hidrogen. Pentru a determina precedența celorlalți doi substituenți CH^ și COOH cu același număr atomic (6 C) în primul strat, este necesar să se ia în considerare al doilea strat. Suma numerelor atomice ale celui de-al doilea strat al grupului CH 3 \u003d 1 + 1 + 1 \u003d 3 și grupului COOH \u003d 8 + 8 * 2 \u003d 24. Aceasta înseamnă că grupul COOH este mai vechi decât grupa -CH 3. scade în seria: OH > COOH > CH 3 > H


Orez. 3.5. Determinarea configurației prin sistemul R,S pentru acid lactic
colegii de cursă. Un amestec de cantități egale de enantiomeri este optic inactiv și se numește amestec racemic (racemat). Racemații diferă de enantiomerii individuali în proprietăți fizice, pot avea diferite puncte de topire, solubilitate; diferă prin caracteristicile lor spectrale.
În practică, mai des trebuie să se ocupe nu de enantiomeri individuali, ci de racemați, care se formează ca urmare a reacțiilor chimice care apar odată cu formarea de molecule chirale.
Sunt utilizate trei metode pentru a separa racemații în enantiomeri:
1. Metoda mecanică. Ca urmare a cristalizării unor compuși optic activi, se pot forma două forme de cristale care sunt similare între ele ca obiect și imaginea lui în oglindă. Ele pot fi separate la microscop cu un ac preparativ (mecanic).
2. Metoda biochimică se bazează pe faptul că anumite tipuri de microorganisme preferă una dintre formele enantiomerice și o mănâncă, a doua rămâne și poate fi izolata cu ușurință.
3. Metoda chimică.Metoda chimică se bazează pe conversia enantiomerilor cu ajutorul unor reactivi optic activi în diastereomeri, care se deosebesc deja între ei ca proprietăți fizice. Diastereomerii sunt mult mai ușor de separat.
De exemplu, un amestec racemic de doi acizi (A + B) trebuie separat. Pentru a face acest lucru, se adaugă la amestec o bază optic activă (C). Reacția dintre forma racemică și baza optic activă este
AC și BC sunt diastereoizomeri. Au solubilitate diferită și metoda de cristalizare succesivă poate izola separat doi diastereomeri.
Dar, deoarece AC și BC sunt formate dintr-un acid organic și o bază slabă, acizii minerali sunt folosiți pentru a le descompune.

În acest fel, se obțin enantiomerii puri A și B.
GEOMETRIE Izomerie
Motivul apariției izomeriei geometrice este lipsa de rotație liberă în jurul legăturii σ. Acest tip de izomerie este tipic pentru compușii care conțin o legătură dublă și pentru compușii din seria aliciclică.
Izomerii geometrici sunt substanțe care au aceeași formulă moleculară, aceeași secvență de atomi de legare în molecule, dar diferă între ei într-o aranjare diferită a atomilor sau grupărilor atomice în spațiu față de planul dublei legături sau planul ciclului .
Motivul apariției acestui tip de izomerie este imposibilitatea de rotație liberă în jurul legăturii duble sau a legăturilor σ care formează ciclul.
De exemplu, buten-2 CH 3 -CH=CH-CH 3 poate exista sub formă de 2 izomeri, care diferă în aranjarea grupărilor metil în spațiu față de planul dublei legături.

sau 1,2-dimetilciclopropanul există ca doi izomeri care diferă în aranjarea grupărilor metil în spațiu față de planul inelar:

Sistemul cis-trans este utilizat pentru a desemna configurația izomerilor geometrici. Dacă aceiași substituenți sunt localizați pe aceeași parte a planului dublei legături sau ciclului, configurația este desemnată cis-. dacă pe laturi diferite - trans-.
Pentru compușii care au substituenți diferiți la atomii de carbon cu o legătură dublă, se utilizează notația Z,E.
Sistemul Z,E este mai general. Este aplicabil la izomerii geometrici cu orice set de substituenți. Acest sistem se bazează pe vechimea substituenților, care este determinată separat pentru fiecare atom de carbon. Dacă substituenții seniori din fiecare pereche sunt localizați pe o parte a legăturii duble, configurația este notă cu litera Z (din germană zusammen - împreună), dacă pe părți opuse - prin litera £ (din germană entgegen - opus).
Deci, pentru 1-bromo-1-cloropropenă, sunt posibili doi izomeri:

Substituentul principal pe un atom de carbon este o grupare metil (substituenții 1 H și 6 CH3). iar celălalt are un atom de brom (substituenți 17 Cl și 35 Br). În izomerul 1, substituenții seniori sunt localizați pe o parte a planului dublei legături, i se atribuie configurația Z, iar izomerul II este configurația E (substituenții superiori sunt localizați pe părțile opuse ale planului dublei legături).
Izomerii geometrici au proprietăți fizice diferite (puncte de topire și de fierbere, solubilitate etc.), caracteristici spectrale și proprietăți chimice. O astfel de diferență în proprietăți face destul de ușoară stabilirea configurației lor folosind metode fizice și chimice.
Izomeria ligandului
Izomeria ligandului este subdivizată în legătură (care este determinată de diferite tipuri de coordonare ale aceluiași ligand) și izomerie adecvată a ligandului.
Existența nitro- și nitrito-complexelor de cobalt(III) de compoziție K 3 și K 3 poate servi drept exemple de izomerie a legăturilor, în care coordonarea ligandului NO 2 - se realizează, respectiv, prin atomul de azot sau prin atom de oxigen. Un alt exemplu este coordonarea ionului tiocianat NCS - printr-un atom de azot sau printr-un atom de sulf, cu formarea de complexe tiocianato-N- sau tiocianato-S.
În plus, liganzii complecși (de exemplu, aminoacizi) pot forma ei înșiși izomeri, a căror coordonare duce la formarea de complexe cu aceeași compoziție cu proprietăți diferite.
izomerie geometrică cauzate de plasarea inegală a liganzilor în sfera interioară unul față de celălalt. O condiție necesară pentru izomeria geometrică este prezența a cel puțin doi liganzi diferiți în sfera interioară de coordonare. Izomeria geometrică se manifestă în principal în compuși complecși având o structură octaedrică, structura unui pătrat plat sau a unei piramide pătrate.
Compușii complecși cu o structură tetraedică, triunghiulară și liniară nu au izomeri geometrici, deoarece locațiile liganzilor de două tipuri diferite în jurul atomului central sunt echivalente.
Complexele având structura unui pătrat plat, în prezența a doi liganzi diferiți L ′ și L ′′, pot avea deja doi izomeri (cis- și trans-):
Un exemplu de compus complex având izomeri cis și trans este diclorodiamina platină (II):
Rețineți că un compus complex cu compoziția unui pătrat plat nu poate avea izomeri: poziția ligandului L ′′ este echiprobabilă în orice colț al pătratului. Când apar doi liganzi diferiți, existența a doi izomeri (cis- și trans-) cu proprietăți diferite este deja posibilă. Astfel, cis-diclorodiamina platină (II) este cristale galben-portocalie, ușor solubile în apă, iar trans-diclorodiamina platină (II) este cristale galben pal, a căror solubilitate în apă este oarecum mai mică decât cea a izomerului cis.
Pe măsură ce numărul de liganzi diferiți din sfera interioară crește, crește numărul de izomeri geometrici. Pentru clorura de nitro(hidroxilamină)amină(piridină)platină(II)Cl s-au obținut toți cei trei izomeri:
Complexele octaedrice pot avea mulți izomeri. Dacă într-un compus complex de acest fel toți cei șase liganzi sunt la fel () sau doar unul diferă de toți ceilalți (), atunci nu există posibilitatea unei aranjamente diferite a liganzilor unul față de celălalt. De exemplu, în compușii octaedrici, orice poziție a ligandului L ′′ față de ceilalți cinci liganzi L′ va fi echivalentă și, prin urmare, nu ar trebui să existe izomeri aici:
Aspect Două liganzii L′′ în octaedric compuși complecși vor duce la posibilitatea existenței doi izomeri geometrici. În acest caz, apar două moduri diferite de aranjare a liganzilor L'' unul față de celălalt. De exemplu, cationul dihidroxotetraaminecobalt(III) + are doi izomeri:
Când încercăm să găsim un alt aranjament reciproc al liganzilor H3N și OH, care ar diferi de cei indicați mai sus, vom ajunge întotdeauna la structura unuia dintre cei deja indicați.
Pe măsură ce numărul de liganzi cu compoziții chimice diferite crește în complex, numărul de izomeri geometrici crește rapid. Compușii de acest tip vor avea patru izomeri, iar compușii de tipul care conțin șase liganzi diferiți vor avea până la 15 izomeri geometrici, astfel de compuși complecși sunt încă puțin înțeleși.
Izomerii geometrici diferă semnificativ în proprietăți fizico-chimice, cum ar fi culoarea, solubilitatea, densitatea, structura cristalină etc.

 I. Izomerie (din grecescul isos - egal) Berzelius, 1830. Izomerii sunt substanțe care au aceeași formulă moleculară (aceeași compoziție calitativă și cantitativă), dar diferă prin succesiunea atomilor de legare și (sau) dispunerea lor în spațiu și au proprietăți diferite.
I. Izomerie (din grecescul isos - egal) Berzelius, 1830. Izomerii sunt substanțe care au aceeași formulă moleculară (aceeași compoziție calitativă și cantitativă), dar diferă prin succesiunea atomilor de legare și (sau) dispunerea lor în spațiu și au proprietăți diferite.
 Berzelius, Jöns Jacob 1779 - 1848 Renumit chimist suedez. Din 1807 profesor de medicină și farmacie la Stockholm.
Berzelius, Jöns Jacob 1779 - 1848 Renumit chimist suedez. Din 1807 profesor de medicină și farmacie la Stockholm.
 C 2 H 6 O dimetil eter Tbp = -24 C alcool etilic Tbp = 78 C n-butan Tbp = -0,5 C C 4 H 10 izobutan Tbp = -11,7 C
C 2 H 6 O dimetil eter Tbp = -24 C alcool etilic Tbp = 78 C n-butan Tbp = -0,5 C C 4 H 10 izobutan Tbp = -11,7 C
 Numărul de izomeri din seria alcanilor 10 butan 2 C 14 H 30 tetradecan 1 858 C 5 H 12 pentan 3 C 15 H 32 pentadecan 4 347 C 6 H 14 hexan 5 C 20 H 42 eicosan C heptan C 7 H 916 52 pentacozan 36 797 588 C 8 H 18 octan 18 C 30 H 62 triacontan 4 111 846 763 C 9 H 20 nonan 35 C 40 H 82 tetracontan 62 491 178 805 decan 7 3 2 3 1 6 decan
Numărul de izomeri din seria alcanilor 10 butan 2 C 14 H 30 tetradecan 1 858 C 5 H 12 pentan 3 C 15 H 32 pentadecan 4 347 C 6 H 14 hexan 5 C 20 H 42 eicosan C heptan C 7 H 916 52 pentacozan 36 797 588 C 8 H 18 octan 18 C 30 H 62 triacontan 4 111 846 763 C 9 H 20 nonan 35 C 40 H 82 tetracontan 62 491 178 805 decan 7 3 2 3 1 6 decan
 II. Omologie Grupurile de compuși organici de același tip de structură cu aceleași grupări funcționale, diferiți între ele prin numărul de grupări -CH 2 - din lanțul de carbon, constituie o serie omoloagă. Serii omoloage de metan
II. Omologie Grupurile de compuși organici de același tip de structură cu aceleași grupări funcționale, diferiți între ele prin numărul de grupări -CH 2 - din lanțul de carbon, constituie o serie omoloagă. Serii omoloage de metan
 III. Seria izologică. l l Acestea sunt serii de substanțe construite din același număr de atomi de carbon, dar care diferă în compoziția cantitativă a atomilor de H, adică fiecare membru următor al seriei conține cu 2 atomi de H mai puțin decât cel anterior: C 2 H 6 etan C 2 H 4 etilenă C2H2 acetilenă
III. Seria izologică. l l Acestea sunt serii de substanțe construite din același număr de atomi de carbon, dar care diferă în compoziția cantitativă a atomilor de H, adică fiecare membru următor al seriei conține cu 2 atomi de H mai puțin decât cel anterior: C 2 H 6 etan C 2 H 4 etilenă C2H2 acetilenă






 Izomeria structurală 3. Tautomerismul (izomeria prototropă sau dinamică) Tautomeria (din greacă ταύτίς - același și μέρος - măsură) este fenomenul de coexistență a două forme izomerice care se află în echilibru mobil și sunt capabile să se transforme spontan una în alta.
Izomeria structurală 3. Tautomerismul (izomeria prototropă sau dinamică) Tautomeria (din greacă ταύτίς - același și μέρος - măsură) este fenomenul de coexistență a două forme izomerice care se află în echilibru mobil și sunt capabile să se transforme spontan una în alta.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="(!LANG:Conformation >С ------- С Conformation >С ------- С
 Izomerie geometrică Izomerii geometrici – au aceeași ordine (secvență) a legăturilor în moleculă, dar diferă prin aranjarea atomilor (grupurilor) în spațiu față de planul dublei legături sau al ciclului mic.
Izomerie geometrică Izomerii geometrici – au aceeași ordine (secvență) a legăturilor în moleculă, dar diferă prin aranjarea atomilor (grupurilor) în spațiu față de planul dublei legături sau al ciclului mic.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="(!LANG: Buten-2 cis și izomeri trans Fiecare atom are >C=C izomeri cis și trans buten- 2 Fiecare atom >C=C
 „pe această parte și pe cealaltă” a râului Leita Cisleitania - denumirea ținuturilor coroanei austriece; afișat cu roșu; 1867 -1918 Transleitania - denumirea ținuturilor coroanei maghiare; afisat cu verde
„pe această parte și pe cealaltă” a râului Leita Cisleitania - denumirea ținuturilor coroanei austriece; afișat cu roșu; 1867 -1918 Transleitania - denumirea ținuturilor coroanei maghiare; afisat cu verde




 E, Z-nomenclatura 2 1 E-1 -nitro-1 -bromo-2 -cloropentena 1 2 Z-1 -nitro-1 -bromo-2 -cloropentena 1. Folosind regulile Kahn-Ingold-Prelog, determinați vechimea relativă dintre substituenți, legați printr-o legătură dublă și să le acorde un număr de vechime de 1 sau 2.
E, Z-nomenclatura 2 1 E-1 -nitro-1 -bromo-2 -cloropentena 1 2 Z-1 -nitro-1 -bromo-2 -cloropentena 1. Folosind regulile Kahn-Ingold-Prelog, determinați vechimea relativă dintre substituenți, legați printr-o legătură dublă și să le acorde un număr de vechime de 1 sau 2.
 a) Un atom cu un număr atomic mai mare este superior unui atom cu un număr mai mic. b) Dacă doi atomi sunt izotopi, atunci atomul cu numărul de masă mai mare are avantajul. 2. Dacă cele mai mari două grupuri sunt situate pe aceeași parte a planului legăturii π, atunci configurația substituenților este notă cu simbolul Z. (din germanul zusammen împreună) Dacă aceste grupuri sunt pe părțile opuse ale π- planul de legătură, atunci configurația este notă cu simbolul E (din germană entgegen opus)
a) Un atom cu un număr atomic mai mare este superior unui atom cu un număr mai mic. b) Dacă doi atomi sunt izotopi, atunci atomul cu numărul de masă mai mare are avantajul. 2. Dacă cele mai mari două grupuri sunt situate pe aceeași parte a planului legăturii π, atunci configurația substituenților este notă cu simbolul Z. (din germanul zusammen împreună) Dacă aceste grupuri sunt pe părțile opuse ale π- planul de legătură, atunci configurația este notă cu simbolul E (din germană entgegen opus)



 Louis Pasteur (27. 12. 1822 -28. 09. 1895) Chimist francez, cel mai mare cercetător al secolului al XIX-lea „Asimetria este ceea ce deosebește lumea organică de cea anorganică” (această lege a pus bazele stereochimiei). Cristalele asimetrice au proprietatea de a se rotește lumina polarizată.
Louis Pasteur (27. 12. 1822 -28. 09. 1895) Chimist francez, cel mai mare cercetător al secolului al XIX-lea „Asimetria este ceea ce deosebește lumea organică de cea anorganică” (această lege a pus bazele stereochimiei). Cristalele asimetrice au proprietatea de a se rotește lumina polarizată.
 Enantiomerii sunt izomeri spațiali ale căror molecule se raportează între ele ca obiect și imagine în oglindă incompatibilă. (din greaca enantios - opus).
Enantiomerii sunt izomeri spațiali ale căror molecule se raportează între ele ca obiect și imagine în oglindă incompatibilă. (din greaca enantios - opus).
 Chiralitate (chiralitate în engleză, din grecescul chéir - mână), un concept în chimie care caracterizează proprietatea unui obiect de a fi incompatibil cu reflectarea lui într-o oglindă plană ideală.
Chiralitate (chiralitate în engleză, din grecescul chéir - mână), un concept în chimie care caracterizează proprietatea unui obiect de a fi incompatibil cu reflectarea lui într-o oglindă plană ideală.






 Fischer Emil Hermann (9 octombrie 1852, Eiskirchen - 15 iulie 1919, Berlin), chimist organic și biochimist german.
Fischer Emil Hermann (9 octombrie 1852, Eiskirchen - 15 iulie 1919, Berlin), chimist organic și biochimist german.


 Proiecțiile Fisher pot fi transformate: l l 1. un număr par de permutări de substituenți nu schimbă formula; 2. un număr impar de permutări ale substituenților conduce la formula antipodului (enantiomerului); 3. este interzisă rotirea formulei cu 90 sau 270, precum și deducerea formulei din acest plan (aceste acțiuni duc la formula antipod); 4. se permite rotirea intregii formule in planul desenului cu 180;
Proiecțiile Fisher pot fi transformate: l l 1. un număr par de permutări de substituenți nu schimbă formula; 2. un număr impar de permutări ale substituenților conduce la formula antipodului (enantiomerului); 3. este interzisă rotirea formulei cu 90 sau 270, precum și deducerea formulei din acest plan (aceste acțiuni duc la formula antipod); 4. se permite rotirea intregii formule in planul desenului cu 180;
 Configurație relativă 1906, la sugestia lui M. A. Rozanov izomerii L și D (din latinescul laevus - stânga și dexter - dreapta).
Configurație relativă 1906, la sugestia lui M. A. Rozanov izomerii L și D (din latinescul laevus - stânga și dexter - dreapta).



 Sistemul Kahn-Ingold-Prelog? Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Marea Britanie) ( Elveția)
Sistemul Kahn-Ingold-Prelog? Robert Sidney Kahn Ingold Christopher Prelog Vladimir (9.06.1899 -15.09.1981) (28.10.1893 - 8.10.1970) (23.07.1906 - 07.01.1998) (Marea Britanie) ( Elveția)



 Numărul total de izomeri optici este determinat de formula N = 2 n , n este numărul de centre de chiralitate. I III IV Acid 2-amino-3-hidroxibutanoic
Numărul total de izomeri optici este determinat de formula N = 2 n , n este numărul de centre de chiralitate. I III IV Acid 2-amino-3-hidroxibutanoic
 Acid tartric I III IV eritrotreo Epimerii sunt diastereomeri care diferă prin configurația unui singur centru asimetric
Acid tartric I III IV eritrotreo Epimerii sunt diastereomeri care diferă prin configurația unui singur centru asimetric

 Racemate (din latinescul racemus - struguri). La amestecarea cantităților echimolare de stereoizomeri D - și L - se formează amestecuri optic inactive, care sunt numite racemice S (din lat. sinistru - stânga) și R (lat. rectus - dreapta); Racematul este notat cu simbolul RS. Divizarea amestecurilor racemice: 1. Metoda mecanică (metoda lui Pasteur). 2. Metoda microbiologică 3. Metoda enzimatică. 4. Metoda chimică. cromatografia de afinitate
Racemate (din latinescul racemus - struguri). La amestecarea cantităților echimolare de stereoizomeri D - și L - se formează amestecuri optic inactive, care sunt numite racemice S (din lat. sinistru - stânga) și R (lat. rectus - dreapta); Racematul este notat cu simbolul RS. Divizarea amestecurilor racemice: 1. Metoda mecanică (metoda lui Pasteur). 2. Metoda microbiologică 3. Metoda enzimatică. 4. Metoda chimică. cromatografia de afinitate
 INTERRELAȚIA STRUCTURII STEREOCHIMICE CU MANIFESTAREA ACTIVITĂȚII BIOLOGICE. Adrenalină, epinefrină IUPAC: 1 - (3, 4 -dihidroxifenil) -2 metilaminoetanol - hormon al medulei suprarenale la animale și la oameni. Mediator al sistemului nervos al animalelor cu sânge rece. Dintre cei doi enantiomeri ai adrenalinei, adrenalina R (-) prezintă cea mai mare activitate farmacologică.
INTERRELAȚIA STRUCTURII STEREOCHIMICE CU MANIFESTAREA ACTIVITĂȚII BIOLOGICE. Adrenalină, epinefrină IUPAC: 1 - (3, 4 -dihidroxifenil) -2 metilaminoetanol - hormon al medulei suprarenale la animale și la oameni. Mediator al sistemului nervos al animalelor cu sânge rece. Dintre cei doi enantiomeri ai adrenalinei, adrenalina R (-) prezintă cea mai mare activitate farmacologică.

 INTERRELAȚIA STRUCTURII STEREOCHIMICE CU MANIFESTAREA ACTIVITĂȚII BIOLOGICE. Izopropiradrenalina dextrogiratoare (Isadrine) este de 800 de ori mai bronhodilatatoare decât enantiomerul său levogitor.
INTERRELAȚIA STRUCTURII STEREOCHIMICE CU MANIFESTAREA ACTIVITĂȚII BIOLOGICE. Izopropiradrenalina dextrogiratoare (Isadrine) este de 800 de ori mai bronhodilatatoare decât enantiomerul său levogitor.

 Diastereomerii sunt izomeri spațiali, ale căror molecule NU au legătură între ele ca obiect și imagine în oglindă incompatibilă.
Diastereomerii sunt izomeri spațiali, ale căror molecule NU au legătură între ele ca obiect și imagine în oglindă incompatibilă.

 Izomeria conformațională Izomeria conformațională apare ca urmare a dispunerii diferite a părților aceleiași molecule unele față de altele, realizată prin rotirea acestor părți în jurul unei legături simple C-C care leagă doi atomi.
Izomeria conformațională Izomeria conformațională apare ca urmare a dispunerii diferite a părților aceleiași molecule unele față de altele, realizată prin rotirea acestor părți în jurul unei legături simple C-C care leagă doi atomi.
 (din lat. conformatio - formă, aranjare), diverse forme spațiale luate de molecule ca urmare a rotației libere a fragmentelor individuale în jurul legăturilor simple C-C.
(din lat. conformatio - formă, aranjare), diverse forme spațiale luate de molecule ca urmare a rotației libere a fragmentelor individuale în jurul legăturilor simple C-C.







 69% 31% Tensiune Van der Waals - datorită forțelor de respingere între substituenții mari fără valență.
69% 31% Tensiune Van der Waals - datorită forțelor de respingere între substituenții mari fără valență.